题目内容
【题目】室温时,向100mL0.1mol/LNH4HSO4溶液中逐滴滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设溶液的体积有加和性)。下列分析正确的是
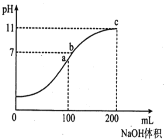
A.ab段和bc段发生的离子反应一定不同
B.水的电离程度最大的是c点
C.b点溶液中各离子浓度由大到小的排列顺序是:C(Na+)>C(NH4+)>C(SO42-)>C(H+)=C(OH-)
D.NH4+的水解平衡常数Kh的数量级为10-10
【答案】D
【解析】
A. NH4HSO4溶液与NaOH反应时H+先反应、NH4+后反应,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液时,当V(NaOH)=100mL时,H+恰好完全反应生成水;当V(NaOH)=200mL时,NH4+恰好完全反应生成![]() ,所以oa段离子方程式为H++OH=H2O、ac段离子方程式为NH4++OH=
,所以oa段离子方程式为H++OH=H2O、ac段离子方程式为NH4++OH=![]() ,所以ab段和bc段发生的离子反应一定相同,故A错误;
,所以ab段和bc段发生的离子反应一定相同,故A错误;
B. 酸或碱抑制水电离,铵根离子促进水电离;a点溶质为(NH4)2SO4、Na2SO4;a到c点溶质为(NH4)2SO4、Na2SO4、![]() ,c点溶质为Na2SO4、
,c点溶质为Na2SO4、![]() ;铵根离子促进水电离、一水合氨抑制水电离,则水电离程度a>b>c,故B错误;
;铵根离子促进水电离、一水合氨抑制水电离,则水电离程度a>b>c,故B错误;
C. 由b点溶质及pH大小知,n(Na+)>0.01mol、n(SO42)=0.01mol,根据物料守恒得n(NH4+)+n(![]() )=0.01mol,n(NH4+)<0.01mol,溶液呈中性,则c(H+)=c(OH),所以存在c(Na+)>c(SO42)>c(NH4+)>c(H+)=c(OH),故C错误;
)=0.01mol,n(NH4+)<0.01mol,溶液呈中性,则c(H+)=c(OH),所以存在c(Na+)>c(SO42)>c(NH4+)>c(H+)=c(OH),故C错误;
D. 由c点溶质及浓度可知,c(![]() )=
)=![]() mol/L,一水合氨电离程度较小,且溶液中c(NH4+)≈c(OH)=0.001mol/L,电离平衡常数Kb=
mol/L,一水合氨电离程度较小,且溶液中c(NH4+)≈c(OH)=0.001mol/L,电离平衡常数Kb=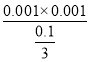 =3×105,
=3×105,![]() ≈3.3×1010,故D正确;
≈3.3×1010,故D正确;
故选:D。

【题目】(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①为 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ![]() 反应②生成1molCl2(g)的反应热为
反应②生成1molCl2(g)的反应热为![]() ,则总反应的热化学方程式为_______________(反应热△H用含
,则总反应的热化学方程式为_______________(反应热△H用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
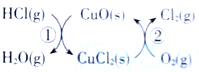
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①该反应的![]() ____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
②100℃时达平衡后,改变反应温度为![]() ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L![]() ·s
·s![]() 的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
③计算温度T时反应的平衡常数K___________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________(填“正反应”或“逆反应”)方向移动,N2O4的转化率______(填“增大”或“减小”)。
时间(s) | 0 | 20 | 40 | 60 | 80 |
N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在 100℃时,pH=6,该温度下 0.1molL﹣1 的 NaOH 溶液中,溶液的 pH=_____。
(2)25℃时,向水中加入少量碳酸钠固体,得到 pH 为 11 的溶液,其水解的离子方程式为_____, 由水电离出的 c(OH﹣)=_____molL﹣1。
(3)体积均为 100mL、pH 均为 2 的盐酸与一元酸 HX,加水稀释过程中 pH 与溶液体积的关系如图所示,则 HX 是_____(填“强酸”或“弱酸”),理由是_____。

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,等浓度的 NaCN 溶液、Na2CO3 溶液和 CH3COONa 溶液,pH 由大到小的顺序为________(填化学式)。
②25℃时,在 0.5mol/L 的醋酸溶液中由醋酸电离出的 c(H+)约是由水电离出的 c(H+)的_________倍。