题目内容
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在 100℃时,pH=6,该温度下 0.1molL﹣1 的 NaOH 溶液中,溶液的 pH=_____。
(2)25℃时,向水中加入少量碳酸钠固体,得到 pH 为 11 的溶液,其水解的离子方程式为_____, 由水电离出的 c(OH﹣)=_____molL﹣1。
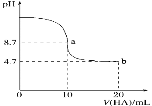
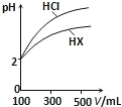
(3)体积均为 100mL、pH 均为 2 的盐酸与一元酸 HX,加水稀释过程中 pH 与溶液体积的关系如图所示,则 HX 是_____(填“强酸”或“弱酸”),理由是_____。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,等浓度的 NaCN 溶液、Na2CO3 溶液和 CH3COONa 溶液,pH 由大到小的顺序为________(填化学式)。
②25℃时,在 0.5mol/L 的醋酸溶液中由醋酸电离出的 c(H+)约是由水电离出的 c(H+)的_________倍。
【答案】(1)11(2分)(2)CO32-+H2O![]() HCO3-+OH-(2分) 10-3(2分)
HCO3-+OH-(2分) 10-3(2分)
(3)弱酸(1分);稀释相同倍数,一元酸HX的pH变化量比HCl的小,说明HX存在电离平衡,故HX为弱酸。(2分) (4)①Na2CO3>NaCN>CH3COONa(2分) ②9×108(2分)
【解析】
试题(1)纯水在100 ℃时,pH=6,这说明该温度下水的离子积常数是10-12,因此该温度下0.1 mol·L-1的NaOH溶液中,氢离子浓度是10-11mol/L,则溶液的pH=11。
(2)25 ℃时,向水中加入少量碳酸钠固体,碳酸根水解,得到pH为11的溶液,则其水解的离子方程式为CO32-+H2O![]() HCO3-+OH-,其中由水电离出的c(OH-)等于溶液中氢氧根离子的浓度,即由水电离出的c(OH-)=10-3mol·L-1。
HCO3-+OH-,其中由水电离出的c(OH-)等于溶液中氢氧根离子的浓度,即由水电离出的c(OH-)=10-3mol·L-1。
(3)根据图像可知,稀释相同倍数时,一元酸HX的pH变化量比HCl的小,这说明HX存在电离平衡,因此HX为弱酸。
(4)①电离常数越大酸性越强,酸性越强相应的钠盐越容易水解,溶液的碱性越强。根据表中数据可知酸性强弱顺序为CH3COOH>H2CO3>HCN>HCO3-,所以25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为Na2CO3>NaCN>CH3COONa。
②根据电离常数可知25 ℃时,在0.5 mol/L 的醋酸溶液中氢离子浓度是![]() mol/L,则溶液中氢氧根离子的浓度是
mol/L,则溶液中氢氧根离子的浓度是![]() ×10-11mol/L,因此醋酸溶液中由水电离出的氢离子浓度也是
×10-11mol/L,因此醋酸溶液中由水电离出的氢离子浓度也是![]() ×10-11mol/L,所以由醋酸电离出的c(H+)约是由水电离出的c(H+)的
×10-11mol/L,所以由醋酸电离出的c(H+)约是由水电离出的c(H+)的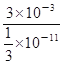 9×108倍。
9×108倍。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】某化学兴趣小组同学用 NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
实验序号 | I | II | III |
盐酸体积(mL) | 100.0 | 100.0 | 100.0 |
样品质量/g | 9.2 | 15.7 | 27.6 |
CO2体积/L (标准状况) | 2.24 | 3.36 | 3.36 |
(1)该盐酸的物质的量浓度为______mol·Lˉ1
(2)使盐酸恰好完全反应,所需要的样品质量为______g