题目内容
【题目】下列反应中,相关坐标图错误的是
A | B | C | D |
向盐酸中滴入NaAlO2溶液 | NaHSO4溶液中逐滴加入 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A.AB.BC.CD.D
【答案】A
【解析】
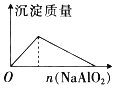
A、向盐酸中滴入NaAlO2溶液,开始一段时间无沉淀产生,A错误;
B、BaSO4不溶于碱性溶液中,反应后沉淀的质量保持不变,B正确;
C、随着反应的进行浓硝酸逐渐变成稀硝酸,反应由Cu+4HNO3(浓)![]() Cu(NO3)2+2H2O+2NO2↑变为3Cu+8HNO3(稀)
Cu(NO3)2+2H2O+2NO2↑变为3Cu+8HNO3(稀)![]() 3Cu(NO3)2+4H2O+2NO↑,C正确;
3Cu(NO3)2+4H2O+2NO↑,C正确;
D、溶液中Cl-的质量不变,因Fe+2Fe3+=3Fe2+溶液质量逐渐增大,所以Cl-的质量分数减小,D正确;
答案选A。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeO(OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是___。
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
a | 7.0 | 8.0 | 9.0 |
FeO(OH)的产率 | <50% | 95% | >95% |
FeO(OH)生成后pH | 接近4 | 接近4 | 接近4 |
用离子方程式解释FeO(OH)生成后溶液pH下降的原因:___。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO(OH)向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeO(OH)向Fe2O3的转化。
①分析,假设i不成立的实验依据是___。
②其他条件相同时,向FeO(OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如表:
c(Fe2+)/molL-1 | FeO(OH)百分含量/% | Fe2O3百分含量/% |
0.00 | 100 | 0 |
0.01 | 40 | 60 |
0.02 | 0 | 100 |
以上结果表明:___。
(3)a=7和a=9时,FeO(OH)产率差异很大的原因是___。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO(OH)红棕色悬浊液中同时加入FeSO4溶波和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3
(4)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是___。
②已知N=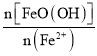 ,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:

经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是___。
【题目】氨在生产生活中应用广泛。
(1) NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,工业上可通过反应:NH3(g)+Cl2(g)=NH2Cl(g) + HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样), 则上述反应的H=__________kJ·mol—1
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ/mol) | a | b | c | d |
(2)氨气是重要的化工产品。目前工业合成氨的原理是: N2(g)+3H2(g) ![]() 2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
a.气体压强不再变化时,表明该反应已达平衡状态
b.气体密度不再变化时,表明该反应已达平衡状态
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,向装置中通入一定量Ar, 平衡不移动
(3)现向三个体积均为5L,温度分别恒定为T1、 T2、T3的恒容密闭容器I、II、 III中,分别充入1 mol N2和3 molH2发生反应: N2(g)+3H2(g) ![]() 2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
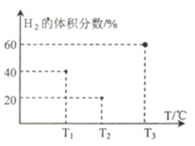
①2min时三个容器中的反应达到化学平衡状态的是_____容器.(填“I”、“II”或“III”)。
②0~2 min内容器I中用NH3表示的化学反应速率v(NH3)=____。 (保留两位有效数字)
③2 min时容器II中v正______ v逆。 (填“<”、 “>”或“=”)
④当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器______(填容器序号),它的数值为____(保留两位有效数字)。
(4)氨在高温下可将一些固体金属氧化物还原为固态或液态金属单质,本身被氧化为N2。在不同温度下,氨气还原四种金属氧化物达到平衡后,气体中![]() 与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
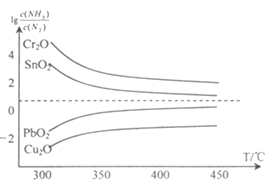
A. NH3还原PbO2的反应△H>0
B.工业冶炼这四种金属时,NH3冶炼金属铬(Cr)的还原效率最低
C.实验室还原出金属铜(Cu)时,325°C 下NH3的利用率比425°C下NH3的利用率更大
D.通过延长反应管的长度来增加金属氧化物和NH3的接触面积,可以减少尾气中NH3的量