题目内容
【题目】(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①为 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ![]() 反应②生成1molCl2(g)的反应热为
反应②生成1molCl2(g)的反应热为![]() ,则总反应的热化学方程式为_______________(反应热△H用含
,则总反应的热化学方程式为_______________(反应热△H用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
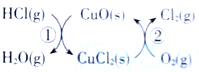
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①该反应的![]() ____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
②100℃时达平衡后,改变反应温度为![]() ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L![]() ·s
·s![]() 的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
③计算温度T时反应的平衡常数K___________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________(填“正反应”或“逆反应”)方向移动,N2O4的转化率______(填“增大”或“减小”)。
时间(s) | 0 | 20 | 40 | 60 | 80 |
N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
【答案】2HCl(g)+![]() O2(g)=Cl2(g)+H2O(g) △H=△H1+△H2(其他合理答案同样给分) > 0.001 > > 1.28(其他合理答案同样给分) 逆反应 减小
O2(g)=Cl2(g)+H2O(g) △H=△H1+△H2(其他合理答案同样给分) > 0.001 > > 1.28(其他合理答案同样给分) 逆反应 减小
【解析】
(1)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+![]() O2(g)=CuO(s)+Cl2(g) △H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式;
O2(g)=CuO(s)+Cl2(g) △H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式;
(2)①随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;反应速率利用公式υ=![]() 计算得到;随着反应的进行,反应物浓度降低,反应速率减慢;
计算得到;随着反应的进行,反应物浓度降低,反应速率减慢;
②N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
③计算T℃时两种物质的浓度,计算得到化学平衡常数;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
(1)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应①为:2HCl(g)+CuO(s)H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+![]() O2(g)=CuO(s)+Cl2(g) △H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2);
O2(g)=CuO(s)+Cl2(g) △H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2);
(2)①随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L-0.04mol/L=0.06mol/L,υ(N2O4)=![]() =0.0010molL-1s-1;若0~60s时段速率是均衡的,则C2应为(0.08+
=0.0010molL-1s-1;若0~60s时段速率是均衡的,则C2应为(0.08+![]() )mol/L=0.10mol/L,而事实上随时间的推移浓度减少,反应速率减慢,则40s时C2 大于0.10mol/L;
)mol/L=0.10mol/L,而事实上随时间的推移浓度减少,反应速率减慢,则40s时C2 大于0.10mol/L;
②N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
③平衡时,c(NO2)=0.120molL-1+0.0020molL-1s-1×10s×2=0.16molL-1,c(N2O4)=0.040molL-1-0.0020molL-1s-1×10s=0.020molL-1,K2=![]() =1.28mol/L;
=1.28mol/L;
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,N2O4的转化率减小。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案