题目内容
12.卤水中含有丰富的镁离子,可制取多种含镁产品.(1)向卤水中加入Ca(OH)2制取Mg(OH)2,其离子方程式是Mg2++Ca(OH)2=Mg(OH)2+Ca2+.
(2)Mg(OH)2可 制取MgO,进而制得金属镁.
①灼烧Mg(OH)2 得到MgO的化学方程式是Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
②1200℃,真空条件下用硅铁(含硅单质95~99%)将MgO还原为镁蒸汽(铁不参与反应),其原理可用化学方程式表示为Si+2MgO$\frac{\underline{\;1200℃\;}}{\;}$2Mg↑+SiO2.
(3)Mg(OH)2可用来制取MgCl2,进而制取金属镁.
①从MgCl2溶液得到MgCl2•6H2O的操作是加热浓缩、冷却结晶、过滤.
②MgCl2•6H2O与SOCl2混合后加热,可获得无水MgCl2(已知SOCl2与水接触时迅速形成白雾,生成SO2).得到无水MgCl2的化学方程式是MgCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+6SO2↑+12HCl↑.
(4)Mg(OH)2还可用来制取三硅酸镁(xMgO•3SiO2).三硅酸镁是医疗上某抗酸药的主要成分.已知硅酸盐的化学式通常用氧化物形式表示,如石棉CaMg3Si4O12表示为3MgO•CaO•4SiO2.
①三硅酸镁中和胃酸的离子方程式是:xMgO•3SiO2+□H+=□Mg2++□SiO2+xH2O
②为确定xMgO•3SiO2中x值.取三硅酸镁样品0.52g,加入0.5000mol/LH2SO4标准液15.00mL,充分反应后,用0.5000mol/L的NaOH标准液滴定过量的H2SO4,消耗NaOH标准液14.00mL.则x=2.
分析 (1)卤水中含有Mg2+,加入Ca(OH)2提供OH-,Mg2+与OH-反应生成Mg(OH)2,
(2)①灼烧Mg(OH)2 得到MgO与水;
②由题目信息可知,Si与MgO反应生成Mg(蒸汽),同时生成二氧化硅;
(3)①从溶液得到晶体,需要经过加热浓缩、冷却结晶、过滤等操作;
②MgCl2•6H2O与SOCl2混合后加热,可获得无水MgCl2与SO2,由元素守恒与白雾现象可知生成HCl;
(4)①三硅酸镁可以看作MgO、SiO2的混合物,MgO与HCl反应生成氯化镁与水,利用原子守恒配平;
②硫酸与氧化镁、氢氧化钠反应生成MgSO4、Na2SO4,根据硫酸根守恒n(H2SO4)=n(MgSO4)+n(Na2SO4),由钠离子守恒2n(Na2SO4)=n(NaOH),联立计算n(MgSO4),再根据Mg原子守恒计算x的值.
解答 解:(1)利卤水中含有Mg2+,加入Ca(OH)2提供OH-,Mg2+与OH-反应生成Mg(OH)2,反应离子方程式为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+,
故答案为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+;
(2)①灼烧Mg(OH)2 得到MgO与水,化学方程式为:Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,
故答案为:Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;
②由题目信息可知,Si与MgO反应生成Mg(蒸汽),同时生成二氧化硅,反应方程式为:Si+2MgO$\frac{\underline{\;1200℃\;}}{\;}$2Mg↑+SiO2,
故答案为:Si+2MgO$\frac{\underline{\;1200℃\;}}{\;}$2Mg↑+SiO2;
(3)①从溶液得到晶体,需要经过加热浓缩、冷却结晶、过滤等操作,
故答案为:加热浓缩、冷却结晶;
②MgCl2•6H2O与SOCl2混合后加热,可获得无水MgCl2与SO2,由元素守恒与白雾现象可知生成HCl,反应方程式为:MgCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+6SO2↑+12HCl↑,
故答案为:MgCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+6SO2↑+12HCl↑;
(4)①三硅酸镁可以看作MgO、SiO2的混合物,MgO与HCl反应生成氯化镁与水,配平后离子方程式为:xMgO•3SiO2+2xH+=xMg2++3SiO2+xH2O,
故答案为:2x;x;3;xH2O;
②硫酸与氧化镁、氢氧化钠反应生成MgSO4、Na2SO4,根据硫酸根守恒n(H2SO4)=n(MgSO4)+n(Na2SO4)=0.5000mol/L×0.015L=0.0075mol,由钠离子守恒2n(Na2SO4)=n(NaOH)=0.5000mol/L×0.014L=0.007mol,则n(Na2SO4)=0.0035mol,故n(MgSO4)=0.004mol,则$\frac{0.004}{x}$×[40x+3×(32+28)]=0.52,解得x=2,
故答案为:2.
点评 本题考查实验制备原理、物质组成的测定、物质的分离提纯、滴定原理应用等,侧重对原理中化学方程式的考查,是对学生综合能力的考查,难度中等.

| A. | 元素W:位于元素周期表中的第三周期,ⅢA族 | |
| B. | 元素X:它的原子中M层比L层少2个电子 | |
| C. | 元素Y:它的焰色反应颜色呈黄色 | |
| D. | 元素Z:它的二价阳离子核外电子总数与氩原子相同 |
| A. | 在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 | |
| B. | 在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 | |
| C. | 在氯碱工业,电解槽一般用铁网作电极 | |
| D. | 合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法 |
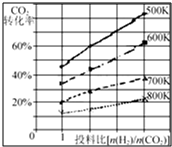 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H=2△H1+△H2-2△H3.(用△H1、△H2和△H3表示)
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
②升高温度,CO2的转化率降低;
③温度越低,增大投料比使CO2的转化率增大的越显著.
(4)为提高CO2的转化率,除了适当改变温度、压强和投料比外,还可以采取的措施是:将水蒸汽液化移去(或移去产物).
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4.与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是浓H2SO4腐蚀设备或有硫酸废液产生.
| A. | Ca(NO3)2 | B. | NaCl | C. | H2O | D. | KOH |
| A. | 由于K=c2(Z)/[c2(X)•c(Y)],随着反应的进行,Z的浓度不断增大,X,Y的浓度不断减小,平衡常数不断增大 | |
| B. | 当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大 | |
| C. | 可逆反应达到平衡时,逆反应便立即停止了 | |
| D. | 温度发生变化,上述的K值也发生变化 |

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
 ;
;