题目内容
17.下列物质中,既有离子键又有共价键的是( )| A. | Ca(NO3)2 | B. | NaCl | C. | H2O | D. | KOH |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐、金属氧化物和铵盐中都含有离子键,据此分析解答.
解答 解:A.硝酸钙中钙离子和硝酸根离子之间存在离子键、N-O原子之间存在共价键,故A正确;
B.NaCl中钠离子和氯离子之间只存在离子键,故B错误;
C.水分子中H-O原子之间只存在共价键,故C错误;
D.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故D正确;
故选AD.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确离子键和共价键的区别是解本题关键,注意化学键和化合物的关系,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度.下表为部分短周期元素的电负性.请回答下列问题.
(1)根据上表给出的数据,可知元素的电负性越大,非金属性(填“金属性”或“非金属性”)越强.
(2)推测Y 为Na(填元素符号),用电子式表示Y元素与氧元素、氢元素形成化合物的电子式: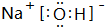 、该物质中的化学键为离子键、共价键.
、该物质中的化学键为离子键、共价键.
(3)写出Y的最高价氧化物水化物与Al反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.该反应的还原剂是Al(填化学式).
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
(2)推测Y 为Na(填元素符号),用电子式表示Y元素与氧元素、氢元素形成化合物的电子式:
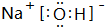 、该物质中的化学键为离子键、共价键.
、该物质中的化学键为离子键、共价键.(3)写出Y的最高价氧化物水化物与Al反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.该反应的还原剂是Al(填化学式).
2.下列共价化合物中所有原子都满足最外层8电子结构的是( )
| A. | 五氯化磷(PCl5) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
9.下列物质中既能使溴水褪色,也能使高锰酸钾酸性溶液褪色的是( )
| A. | 对二甲苯 | B. | 丙烯 | C. | 丙炔 | D. | 溴乙烷 |
6.下列物质中,既能发生取代反应,又能发生消去反应,同时催化氧化生成醛的是( )
| A. | 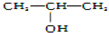 | B. | 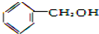 | C. | CH3OH | D. | 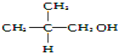 |
7.下列说法不正确的是( )
| A. | 1mol有机物 分别能与1molNa2CO3、2molNa、3molBr2、4molNaOH反应 分别能与1molNa2CO3、2molNa、3molBr2、4molNaOH反应 | |
| B. | 有机物分子 与银氨溶液作用后仍具有光学活性 与银氨溶液作用后仍具有光学活性 | |
| C. |  的正确命名为2,3,3,6,6-五甲基-4-乙基庚烷 的正确命名为2,3,3,6,6-五甲基-4-乙基庚烷 | |
| D. | 2-甲基-1,3-丁二烯在一定温度下和Br2按物质的量之比1:1发生加成反应,所得产物主要有三种 |
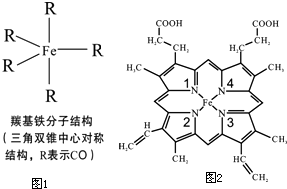 Fe、C、N、O、H可以组成多种物质.回答以下问题:
Fe、C、N、O、H可以组成多种物质.回答以下问题: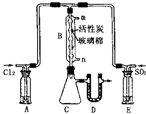 已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.
已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.