��Ŀ����
����Ŀ���̷�(FeSO4��7H2O)������ԭ������ɫ������ҩ�ȣ��ڲ�ͬ�¶����ֽ�ø������������������������֪SO3��һ����ɫ���壬�۵�16.8�棬�е�44.8�棬�����Լ���ˮ�Խ�Ũ����ǿ��������Ũ���ᣬ��Ư��ijЩ�л�Ⱦ�ϣ���Ʒ��ȡ��ش���������:

(1)����ͬѧ������ͼ��ʾװ�ã�ͨ��ʵ������̷��ֽ���װ��B�пɹ۲쵽��������______________________________�������ɴ˵ó��̷��ķֽ�����к���SO2��
(2)����ͬѧ��Ϊ����ʵ����۲��Ͻ����Լ���ͬѧ����ʵ���Bװ�õ��Թܼ��ȣ�������ɫ��Ʒ����Һδ�ָ���ɫ�����֤���̷��ֽ�IJ�����____________(����ĸ)��
A.����SO2 B.���ܺ�SO2 C.һ������SO3
(3)����ͬѧ�������Ϸ����̷����ȷֽ������O2�ų���Ϊ�ˣ�����ͬѧѡ�ü���ͬѧ�IJ���ʵ��װ�ü�����װ��������װ�����̷��ֽ�������̬������н�һ����֤: 
��װ��F��������������______________________��
�ڱ���ͬѧ��ʵ��װ���У��������ӵĺ���˳��ΪA��F��____��____��____��D��H(ÿ������ֻ��ʹ��һ��)����ʵ������У�SO3�Ժ��������ⲻ�������ŵ�������____________��
��ʵ����ɺ�A�Թ��в����ĺ�ɫ������_________����֤���̷��ֽ��������O2�ļ��鷽����______________________________________________________��
����֪ʵ��ǰװ��A�Թ�����ȡ���̷�������mg������һ��ʱ��������Թ��м���������ϡ���ᣬ����Ũ��Ϊc mol/L��KMnO4��Һ�ζ�������ζ��յ�ʱ������KMnO4��Һ�����ΪVmL�����̷����ȷֽ�����У���Ԫ�ر������İٷ���Ϊ____________��
���𰸡� Ʒ����Һ��ɫ BC ���θ���� G��E��B װ��E���ް�ɫ�������� Fe2O3 ��H�еĵ����Ƴ�ˮ�棬���߾ƾ��ƣ���Ĵָ��ס�Թܿڣ�ȡ���Թܣ������Ѵ����ǵ�ľ�������Թ��ڣ�ľ����ȼ��֤���Թ����ռ������������� [(m-1.39cV)/m]��100%
��������(1)�����ɴ˵ó��̷��ķֽ�����к���SO2��װ��B��ΪƷ����Һ������������Ư���ԣ���װ��B��Ʒ����Һ��ɫ���ʴ�Ϊ��Ʒ����Һ��ɫ��
(2)��������SO3�����Լ���ˮ�Խ�Ũ����ǿ����Ư��ijЩ�л�Ⱦ�ϣ���Ʒ�죬���������Ư�ײ��ɻָ����ҶԼ���ͬѧ����ʵ���Bװ�õ��Թܼ��ȣ�������ɫ��Ʒ����Һδ�ָ���ɫ�����֤���̷��ֽ�IJ����п϶�����������δ�Զ���������飬�ʿ��ܺ��ж����������ʴ�Ϊ��BC��
(3)��װ��F������Ϊ���θ���ܣ��ʴ�Ϊ�����θ���ܣ�
�ڼ����̷��ֽ����̬�������Ƿ����������̷��ֽ�IJ����п��ܺ��ж���������������������ˮ��������Ҫ�����������ȥ��F�е���ˮ����ͭ���Լ���ˮ��������Ҫ���ȼ��飻SO3��һ����ɫ���壬�۵�16.8�棬�е�44.8�棬����ͨ��G�У��������������������������ΪҺ�壻Ȼ�����Ȼ����������������Ƿ���ȫ��������������������Һ��ȥ���������������ˮ�������ռ��������ɵ�������װ��E�Ǽ������������Ƿ���ȫ������SO3�Ժ��������ⲻ�������ţ���Ҫװ��E���ް�ɫ�������ɣ��ʴ�Ϊ��G��E��B��װ��E���ް�ɫ�������ɣ�
�ۺ�����Ԫ�صĺ�ɫ�������������������ռ���H�У���������֧��ȼ�յ����ʼ��飬����Ϊ����H�еĵ����Ƴ�ˮ�棬���߾ƾ��ƣ���Ĵָ��ס�Թܿڣ�ȡ���Թܣ������Ѵ����ǵ�ľ�������Թܿ��ڣ�ľ����ȼ��֤���Թ����ռ����������������ʴ�Ϊ��Fe2O3����H�еĵ����Ƴ�ˮ�棬���߾ƾ��ƣ���Ĵָ��ס�Թܿڣ�ȡ���Թܣ������Ѵ����ǵ�ľ�������Թܿ��ڣ�ľ����ȼ��֤���Թ����ռ���������������
��mg�̷������ʵ���=![]() =
=![]() mol����n(Fe2+)=
mol����n(Fe2+)=![]() mol���ζ����ĵĸ�����ص����ʵ���=c mol/L��V��10-3L= cV��10-3mol������MnO4-+ 5Fe2++8H+=Mn2++5Fe3++4H2O��֪�ζ����������ӵ����ʵ���=5cV��10-3mol�����̷����ȷֽ�����У���Ԫ�ر������İٷ���=
mol���ζ����ĵĸ�����ص����ʵ���=c mol/L��V��10-3L= cV��10-3mol������MnO4-+ 5Fe2++8H+=Mn2++5Fe3++4H2O��֪�ζ����������ӵ����ʵ���=5cV��10-3mol�����̷����ȷֽ�����У���Ԫ�ر������İٷ���=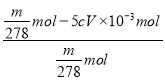 ��100%=
��100%=![]() ��100%���ʴ�Ϊ��
��100%���ʴ�Ϊ�� ![]() ��100%��
��100%��