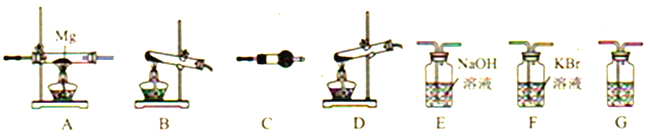
��Ŀ����
����Ŀ����ľ�ҵ���Ч�ɷ���K2CO3��������������Na����Cl����SO42���ʹ���������ˮ�Ĺ��塣Ϊ�ⶨ����K2CO3�ĺ������������ʵ�飺

���������գ�
��1��ϴ��������Ŀ����_____________________________________��
��2������100 mL��ľ�ҽ���Һ����Ҫʹ�õIJ����������ձ�������������ͷ�ιܡ�______��
��3��ȡ��10.00 mL����Һ���еζ����յ�ʱ��Һ��______ɫ���______ɫ��������ƽ��ʵ���������������ƽ��ֵΪ25.00 mL�������Ʒ��̼��ص���������Ϊ______����ȷ��С�����3λ����
��4����û���ñ�Һ��ϴ�ζ��ܣ���ʵ������___������ƫ��������ƫС��������Ӱ��������
��5��������ͼװ�ã�ͨ����Ӧǰ���������ĸı䣬ȷ��CO2�����������Ҳ���Բⶨ��Ʒ��̼��صĺ�����ʵ��ʱ������Ӧ�����ӷ���ʽΪ_______________________���жϷ�Ӧ��ȫ��������_____________________����Ը�ʵ�鷽������ȱ��������ۡ�________________

���𰸡� ����������������̼���ϴ��������һ�����Ƴɴ���Һ������������� 100 mL����ƿ ��ɫ ��ɫ 0.115 ƫ�� CO32����2H�� �� CO2����H2O ������ƽ�Ķ������ٷ����仯 �ŵ㣺������㣻ȱ�㣺�ݳ��Ķ�����̼�к���ˮ�������Ȼ��⣬����ɽϴ�ʵ�����
����������1��ϴ��������Ŀ���ǽ���������������̼���ϴ��������һ�����Ƴɴ���Һ��������������2������������������֪����ȱ��100mL����ƿ����3��ȡ��10.00 mL����Һ���еζ����յ�ʱ��Һ�ɻ�ɫ��ɳ�ɫ��������ƽ��ʵ���������������ƽ��ֵΪ25.00 mL�������Ʒ��̼��ص���������Ϊ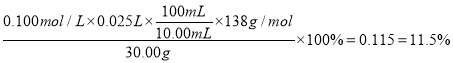 ����4����û���ñ�Һ��ϴ�ζ��ܣ���ҺŨ�ȱ�ϡ���ζ�ʱ���ı�Һƫ�࣬��ʵ������ƫ������5��������ͼװ�ã�ͨ����Ӧǰ���������ĸı䣬ȷ��CO2�����������Ҳ���Բⶨ��Ʒ��̼��صĺ�����ʵ��ʱ������ӦΪ̼��������ᷴӦ��������ء�������̼��ˮ����Ӧ�����ӷ���ʽΪCO32����2H�� �� CO2����H2O���жϷ�Ӧ��ȫ�������ǵ�����ƽ�Ķ������ٷ����仯����ʵ�鷽������ȱ�㣺�ŵ㣺������㣻ȱ�㣺�ݳ��Ķ�����̼�к���ˮ�������Ȼ��⣬����ɽϴ�ʵ����
����4����û���ñ�Һ��ϴ�ζ��ܣ���ҺŨ�ȱ�ϡ���ζ�ʱ���ı�Һƫ�࣬��ʵ������ƫ������5��������ͼװ�ã�ͨ����Ӧǰ���������ĸı䣬ȷ��CO2�����������Ҳ���Բⶨ��Ʒ��̼��صĺ�����ʵ��ʱ������ӦΪ̼��������ᷴӦ��������ء�������̼��ˮ����Ӧ�����ӷ���ʽΪCO32����2H�� �� CO2����H2O���жϷ�Ӧ��ȫ�������ǵ�����ƽ�Ķ������ٷ����仯����ʵ�鷽������ȱ�㣺�ŵ㣺������㣻ȱ�㣺�ݳ��Ķ�����̼�к���ˮ�������Ȼ��⣬����ɽϴ�ʵ����

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�