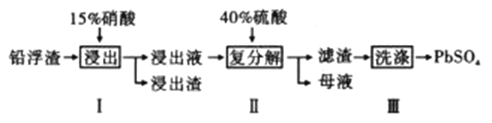
��Ŀ����
����Ŀ���ں����ܱ�������ͨ��X��������Ӧ��2X��g��Y��g�����¶�T1��T2��X�����ʵ���Ũ��c��X����ʱ��t�仯��������ͼ��ʾ������������ȷ���ǣ������� 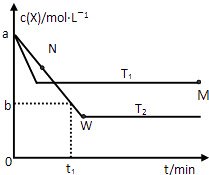
A.�÷�Ӧ���е�M��ų����������ڽ��е�W��ų�������
B.T2�£���0��t1ʱ���ڣ�v��Y��= ![]() molL��1min��1
molL��1min��1
C.M�������Ӧ����V������N����淴Ӧ����V��
D.M��ʱ�ټ���һ����X��ƽ���X��ת���ʼ�С
���𰸡�C
����������ͼ��֪���¶�ΪT1�ȵ���ƽ�⣬����T1��T2���¶�Խ�ߣ�ƽ��ʱX�����ʵ���Ũ��Խ��˵�������¶�ƽ�����淴Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ������淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ��
A������ͼ���жϲμӷ�Ӧ��X�����Ķ��٣���Ӧ��XԽ�࣬����Խ�ࣻ
B������ͼ��X��Ũ�ȱ仯���Y��Ũ�ȱ仯������Ӧ���ʣ�
C���¶�Խ�߷�Ӧ����Խ��
D��M��ʱ�ټ���һ����X���ﵽ����ƽ����ԭƽ��Ƚϣ�����ѹǿ��ƽ���Ӱ�������
�⣺��ͼ��֪���¶�ΪT1�ȵ���ƽ�⣬����T1��T2���¶�Խ�ߣ�ƽ��ʱX�����ʵ���Ũ��Խ��˵�������¶�ƽ�����淴Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ������淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ��
A�����е�M��X��ת���ʽϵͣ����������Ƿ��ȷ�Ӧ�����Է�Ӧ���е�M��ų��������٣���A����
B��T2�£���0��t1ʱ���ڣ�X��Ũ�ȱ仯Ϊ��c��X��=��a��b��mol/L����Y��Ũ�ȱ仯Ϊc��Y��= ![]() c��X��=
c��X��= ![]() mol/L������v��Y��=
mol/L������v��Y��= ![]() molL��1min��1����B����
molL��1min��1����B����
C������ͼ���֪���¶�ΪT1ʱ��Ӧ���ȴﵽƽ��״̬���¶ȸ߷�Ӧ���ʿ죬����ƽ���ʱ���٣����¶���T1��T2��M���¶ȸ���N���¶ȣ���N�㷴Ӧû�дﵽƽ��״̬����ʱ��Ӧ������Ӧ������У���N����淴Ӧ����С��N�������Ӧ���ʣ����M�������Ӧ���ʴ���N����淴Ӧ���ʣ���C��ȷ��
D��M��ʱ�ټ���һ����X���ﵽ����ƽ����ԭƽ��Ƚϣ�ѹǿ��������ѹǿƽ�����ƣ���X��ת������������M��ʱ�ټ���һ����X��ƽ���X��ת��������D����
��ѡC��

 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д� С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д�����Ŀ��������ʵ���У����Ը�����ijЩ��ѧ�Լ�����������ɫ��Ӧ�����������֯�е��й��л�������Ĵ��ڡ�������ʵ���б��У���ȷ����(����)
ѡ�� | ���������� | ʹ���Լ� | ������ɫ |
A | ƻ���еĻ�ԭ�� | ����Լ� | �ٻ�ɫ |
B | �������еĵ��� | ˫�����Լ� | ��ɫ |
C | ������֬�� | �յ���ȾҺ | �ٻ�ɫ |
D | ���еĵ����� | ����Լ� | ��ɫ |
A. A B. B C. C D. D