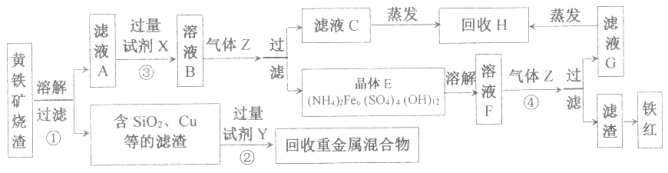
题目内容
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的重大贡献。
Ⅰ理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池,回答下列问题:

(1)该电池的正极材料是______,负极材料是_______,电解质溶液是____________;
(2)正极的反应式为______________________
(3)若导线上转移电子2 mol,则生成银________克。
Ⅱ将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(4)在相同时间内,两烧杯中产生气泡的速度:甲_______乙(填“>”、“<“或“=” )。
(5)请写出图中构成原电池的负极电极反应式_______________。 电池工作时,溶液中SO42-向______极(填正、负)移动,电池工作完成后,溶液中SO42-浓度_______(填增大或减小或不变)。
【答案】碳棒或者Pt 铜(Cu) AgNO3溶液 Ag++e-=Ag或者2Ag++2e-=2Ag 216 > Zn -2e-= Zn2+ 负 不变
【解析】
Ⅰ在Cu+2Ag+=2Ag+Cu2+反应中,Cu被氧化,应为原电池的负极,电解反应为:Cu-2e-=Cu2+,Ag+得电子被还原生成单质Ag,正极上有银白色物质生成,电极反应为Ag++e-=Ag,应为原电池正极反应,正极材料为活泼性比Cu的金属或非金属材料,电解质溶液为含Ag+离子的溶液,如AgNO3,原电池工作时,电子从负极经外电路流向正极,溶液中阳离子向正极移动,阴离子向负极移动,以形成闭合回路。
Ⅱ甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应。
Ⅰ(1)在Cu+2Ag+=2Ag+Cu2+反应中,正极为碳棒或者Pt,Cu被氧化,应为原电池的负极,电解反应为:Cu-2e-=Cu2+,电解质溶液为含Ag+离子的溶液,如AgNO3,故答案为: 碳棒或者Pt;铜(Cu);AgNO3溶液;
(2)正极的反应式为Ag++e-=Ag或者2Ag++2e-=2Ag ;故答案为:Ag++e-=Ag或者2Ag++2e-=2Ag ;
(3)若导线上转移电子2 mol,由电极方程式Ag++e-=Ag,生成2molAg,m(Ag)=108g·mol-1 ×2mol=216g,则生成银216 克。故答案为:216 ;
Ⅱ(4)在相同时间内,两烧杯中产生气泡的速度:原电池原理引起的腐蚀速度大于化学腐蚀的速度,甲>乙,故答案为:>;
(5)构成原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,电池工作时,SO42-流向负极,由于硫酸根离子未参与电极反应,故反应完成后浓度不变,故答案为:Zn-2e-=Zn2+;负;不变。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案【题目】下列实验操作、现象与结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl固体 | 溶液颜色变浅 | FeCl3+3KSCN +3KCl平衡向逆反应方向移动 |
B | 向酸性高锰酸钾溶液中加入过量的FeI2固体 | 反应后溶液变黄 | 反应后溶液中存在大量Fe3+ |
C | 取3mL1 mol·L-1NaOH溶液,先加入3滴1 mol·L-1 MgCl2溶液,再加入3滴1 mol·L-1FeCl3溶液 | 出现红褐色沉淀 | Mg(OH)2的Ksp比Fe(OH)3的Ksp大 |
D | 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 结合质子的能力:CO32->HCO3- |
A. AB. BC. CD. D
【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:
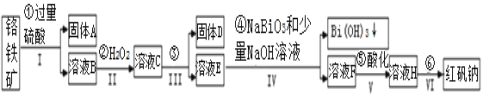
查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是__________________。
(2)步骤③加的试剂为_____________,此时溶液pH要调到5的目的_______________ 。
(3)写出反应④的离子反应方程式______________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式_________________。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是__________________(填操作名称)。
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量