题目内容
【题目】研究碳氧化合物、氮氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。
(1)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H<0。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
4N2(g)+6H2O(g)△H<0。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。

①工业上选择催化剂__________(填“甲”或“乙”)。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________。(写一条即可)。
(2)某研究小组对反应NO2+SO2![]() SO3+NO△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。
SO3+NO△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。
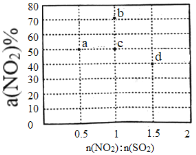
①如果将图中b点的平衡状态改变为c点的平衡状态,应采取的措施是________________。
②图中a、d两点对应的实验温度分别为T1和T2,则T1_______T2(填“>”、“=”或“<”)。
(3)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如图所示。
①太阳能电池的正极为_____(填“a”或“b”)。
②生成丙烯的电极反应式是_____________________________。
③当生成标准状况下2.24L丙烯时,右侧溶液中质量减少____g。

【答案】乙 一定不是 催化剂活性降低、副反应增多 升高温度 > b 3CO2+18H++18e-=C3H6+6H2O 16.2
【解析】
(1)①图象中催化剂在低温下NO转化率大;
②甲催化剂随温度升高NO转化率先增大后减小是因为催化剂在温度高的条件下催化活性减小;高于210℃时,NO转化率降低是催化剂活性降低;
(2)①如果要将b点的平衡状态改变为c点的平衡状态,即在不改变物料比的情况下,降低NO2的平衡转化率,考虑温度和压强对化学平衡的影响;
②图中a、d两点对应的实验温度分别为T1和T2,温度和平衡常数有关,结合图中的数据,分别计算a和d点时的化学平衡常数,据此判断两点温度;
(3)由示意图可知,二氧化碳得电子和氢离子反应生成丙烯和水,为阴极反应,电极方程式为3CO2+18H++18e-=C3H6+6H2O,则a为负极,b为正极,阳极生成氧气。
(1)①图象中曲线变化可知低温下乙的催化作用强,工业上选择催化剂乙的原因是低温下有很强的催化活性,故答案为:低温下有很强的催化活性;
②甲催化剂随温度升高NO转化率先增大后减小是因为催化剂在温度高的条件下催化活性减小,在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率一定不是该温度下的平衡转化率,高于210℃时,NO转化率降低是催化剂活性降低,副反应增多,故答案为:一定不是;催化剂活性降低、副反应增多;
(2)①如果要将图中b点的平衡状态改变为c点的平衡状态,,即在不改变物料比的情况下,降低NO2的平衡转化率,该反应为气体体积不变的放热反应,压强变化对化学平衡不产生影响,减小NO2的平衡转化率,可采取升高温度的方式,使化学平衡向正反应方向移动,故答案为:升高温度;
②该反应为放热反应,升高温度,使化学平衡向正反应方向移动,NO2的平衡转化率减小,因NO2的平衡转化率a点高于d点,则T1大于T2,故答案为:>;
(3)①由示意图可知,二氧化碳得电子和氢离子反应生成丙烯和水,为阴极反应,则a为负极,b为正极,故答案为:b;
②二氧化碳在阴极上得电子和氢离子反应生成丙烯和水,则生成丙烯的阴极电极反应式为3CO2+18H++18e-=C3H6+6H2O,故答案为:3CO2+18H++18e-=C3H6+6H2O;
③阳极上水放电生成氧气,电极反应式为2H2O—4 e-=O2+4H+↑,2.24L丙烯的物质的量为0.1mol,当生成标准状况下2.24L丙烯时,二氧化碳得到1.8 mol电子,右侧溶液中减少质量为阳极消耗0.9mol H2O的质量,0.9mol H2O的质量为0.9mol×18g/mol=16.2g,故答案为:16.2g。

 名校课堂系列答案
名校课堂系列答案