题目内容
9.试回答下列问题(温度均为25℃时):(1)1mL pH=12的NaOH溶液,加水稀释至100mL,稀释后的溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-6.
(2)pH=13的Ba(OH)2溶液 a L与pH=3的H2SO4溶液b L混合.若所得混合溶液呈中性,则a:b=1:100;
(3)向明矾溶液中缓慢加入Ba(OH)2溶液至硫酸银离子刚好沉淀完全时,溶液的pH>7(填>、<、=),离子反应方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
分析 (1)根据溶液稀释前后溶质的物质的量浓度不变计算出稀释后氢氧根离子浓度,再计算出氢离子浓度,最后计算出$\frac{c({H}^{+})}{c(O{H}^{-})}$;
(2)根据反应后溶液为中性可知:n(H+)=n(OH-),据此列式计算;
(3)假设SO42-的物质的量为2mol,判断完全反应需要其它离子的物质的量,进而书写反应的离子方程式,并判断溶液的酸碱性.
解答 解:(1)常温下pH=12的NaOH溶液中氢氧根离子的浓度为0.01mol/L,加水稀释至100mL,稀释过程中溶质的物质的量不变,
则稀释后的溶液中c(OH-)=$\frac{0.01mol/L×0.001L}{0.1L}$=1×10-4mol/L,此时氢离子浓度为:c(H+)=1×10-10mol/L,
则:$\frac{c({H}^{+})}{c(O{H}^{-})}$=$\frac{1×1{0}^{-4}}{1×1{0}^{-10}}$=1×10-6,
故答案为:1×10-6;
(2)常温下pH=13的Ba(OH)2溶液 a L与pH=3的H2SO4溶液b L混合,若所得混合溶液呈中性,则满足:n(H+)=n(OH-),
即:0.1mol/L×2×aL=0.001mol/L×2×bL,
整理可得:a:b=1:100,
故答案为:1:100;
(3)假设明矾为1mol,则明矾溶液中含有2molSO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol、OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,偏铝酸根离子部分水解,则反应后溶液呈碱性,pH>7,
故答案为:>;Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的计算方法为解答关键,注意掌握酸碱混合的定性判断方法,(3)为易错点,注意明确解答方法与技巧.

| 选项 | ① | ② | ③ | 实验结论 | 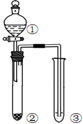 |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2 | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 增大压强可提高反应速率 | B. | 升高温度可减小反应速率 | ||
| C. | 达到平衡时,v(正)=v(逆)=0 | D. | 达到平衡时,NO2转化率为100% |

 表示某粒子的结构示意图.
表示某粒子的结构示意图.