题目内容
1.乙醇燃料电池在H2SO4条件下的电极方程式为负极:C2H5OH-12e-+3H2O=2CO2↑+12 H+、正极O2+4e-+4H+=2H2O、电池C2H5OH+3O2=2CO2↑+3H2O,C3H8在碱性条件下的电极方程式为负极:C3H8-20e-+26OH-=3CO32-+17H2O、正极:O2+4e-+2H2O=4OH-、电池:5O2+C3H8+6OH-=3CO32-+7H2O,C2H6和O2在熔融Na2CO3下的电极方程式为负极:C2H6-14e-+7CO32-=9CO2+3H2O、正极:O2+4e-+2CO2=2CO32-、电池:2C2H6+7O2=4CO2+6H2O(包括正负极和总电极方程式).分析 C2H5OH燃料电池中,负极上通入燃料,酸性条件下C2H5OH失电子生成CO2和 H+,正极上O2得电子和H+反应生成H2O,电池反应式为C2H5OH和O2反应生成CO2、H2O;
碱性条件下,C3H8在负极上失电子和OH-生成CO32-和H2O,正极上O2得电子和H2O反应生成OH-,电池反应式为C3H8、O2和OH-反应生成CO32-和H2O;
熔融Na2CO3条件下,负极上C2H6失电子和CO32-反应生成CO2、H2O,正极上O2得电子和CO2反应生成CO32-,电池反应式为C2H6和O2反应生成CO2、H2O.
解答 解:酸性条件下,乙醇燃料电池中,负极上甲醇失电子生成二氧化碳和氢离子,电极反应式为C2H5OH-12e-+3H2O=2CO2↑+12 H+,正极上氧气得电子和H+反应生成H2O,电极反应式为O2+4e-+4H+=2H2O,电池反应式为C2H5OH+3O2=2CO2↑+3H2O;
碱性条件下,C3H8在负极上失电子和OH-生成CO32-和H2O,电极反应式为
C3H8-20e-+26OH-=3CO32-+17H2O,正极上O2得电子和H2O反应生成OH-,电极反应式为O2+4e-+2H2O=4OH-,电池反应式为C3H8、O2和OH-反应生成CO32-和H2O,
电池反应式为5O2+C3H8+6OH-=3CO32-+7H2O;
熔融Na2CO3条件下,负极上C2H6失电子和CO32-反应生成CO2、H2O,负极反应式为C2H6-14e-+7CO32-=9CO2+3H2O,正极上O2得电子和CO2反应生成CO32-,电极反应式为O2+4e-+2CO2=2CO32-,电池反应式为C2H6和O2反应生成CO2、H2O,电池反应式为2C2H6+7O2=4CO2+6H2O,
故答案为:负极:C2H5OH-12e-+3H2O=2CO2↑+12 H+、正极O2+4e-+4H+=2H2O、电池C2H5OH+3O2=2CO2↑+3H2O;
负极:C3H8-20e-+26OH-=3CO32-+17H2O、正极:O2+4e-+2H2O=4OH-、电池:5O2+C3H8+6OH-=3CO32-+7H2O;
负极:C2H6-14e-+7CO32-=9CO2+3H2O、正极:O2+4e-+2CO2=2CO32-、电池:2C2H6+7O2=4CO2+6H2O.
点评 本题考查电极反应式、电池反应式的书写,为高考高频点,电极反应式的书写要结合电解质特点书写,书写条件下不能生成氢氧根离子、碱性条件下不能生成氢离子,难点是熔融盐或熔融氧化物条件下燃料电池电极反应式的书写,题目难度中等.

| A. | H2O | B. | I2 | C. | NH4Cl | D. | CaCl2 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | D、E形成的简单离子的还原性:E->D- | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |

| A. | 铅蓄电池的A极为负极,电极材料为Pb | |
| B. | 铅蓄电池工作过程中每通过电路中2mol电子则消耗1molH2SO4 | |
| C. | 该电解池的阴极反应为 2NO3-+6H2O+10e-=N2↑+12OH- | |
| D. | 若电解过程中转移5moL电子,则交换膜两侧电解液的质量变化差(△m左-△m右)为14.4g |
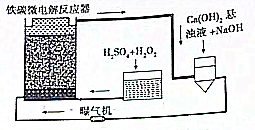 铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示.
铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示.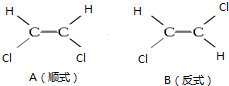 1,2一二氯乙烯有如图两种结构.
1,2一二氯乙烯有如图两种结构.
 无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):
无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):