题目内容
14. 表示某粒子的结构示意图.
表示某粒子的结构示意图.(1)指出各符号的意义:
+X质子数,Y最内层电子数,L最外层电子数;
(2)指出X、Y、L的取值范围.
X3<X≤13;Y2;L≤8;
(3)比较X与(Y、L)的大小,得出什么结论?
分析 在原子结构示意图中圆圈内数字表示质子数,弧线表示电子层,离圆圈最远的弧线表示最外层,最内层电子数不超过2个,最外层电子数不超过8个,第二层电子数最多为8个,据此解答即可.
解答 解:(1)在原子结构示意图中圆圈内数字表示质子数,即+X表示此原子质子数为X,Y表示此原子最内层电子数,L表示此原子第二层电子数,故答案为:质子数;最内层电子数;第二层电子数(或最外层电子数);
(2)由于弧线表示电子层,故此微粒有2个电子层,最多容纳电子数为2+8+3,最少电子数为3,故3<X≤13,Y为最内层电子数,只能为2,L是最外层电子数,最多为8,故L≤8,故答案为:3<X≤13;2;L≤8;
(3)若X>Y+L,则此微粒为阳离子,若X=Y+L,则此粒子为原子;若X<Y+L,则此粒子为阴离子,
答:若X>Y+L,则此微粒为阳离子,若X=Y+L,则此粒子为原子;若X<Y+L,则此粒子为阴离子.
点评 本题主要考查的是原子结构示意图(或离子结构示意图)的认识,掌握质子数与核外电子数的关系即可轻松解答,难度不大.

练习册系列答案
相关题目
4.已知下表数据:
对于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液,下列说法正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到的是红褐色沉淀 | |
| B. | 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 | |
| C. | 向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液 | |
| D. | 向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
2. 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的正极 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 反应2NH4++2e-=2NH3↑+H2↑在负极上发生 |
19.某温度下,在2L密闭容器中充入一定量的N2O5,发生反应:2N2O5?4NO2+O2.反应开始时,c(N2O5)=0.04mol•L-1,30s后,c(O2)=0.01mol•L-1,则N2O5的平均反应速率为( )
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
6.下表为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | D、E形成的简单离子的还原性:E->D- | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
14.向100mLFeCl3 溶液中通入标准状况下的H2S气体3.36L,设 H2S全部被吸收后,再加入过量的铁粉,待反应停止后,测得溶液中含有0.6mol金属阳离子,则原FeCl3溶液的物质的量浓度为( )
| A. | 5.0 m o l/L | B. | 4.0 m o l/L | C. | 4.5 m o l/L | D. | 3.0 m o l/L |
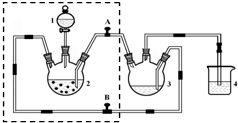 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下: