题目内容
20.某有机物的蒸气密度是相同状况下甲烷密度的3.625倍.把1.16g该有机物在氧气中充分燃烧,将生成的混合物依次通过足量浓硫酸和碱石灰,分别增重1.08g和2.64g,试求该有机物的分子式,要求有一定的答题步骤.分析 根据相对密度计算有机物的相对分子质量,燃烧产物通过浓硫酸和碱石灰分别增重1.08g为水的质量,2.64g为二氧化碳的质量,根据n=计算水、二氧化碳的物质的量,根据原子守恒计算有机物分子中C、H原子数目,结合相对分子质量确定是否含有氧原子及氧原子的数目,进而确定有机物的分子式.
解答 解:(1)有机物的蒸气密度是相同状况下甲烷密度的3.625倍,则有机物的相对分子质量=3.625×16=58,
1.16g该有机物的物质的量==0.02mol,
浓硫酸增重的为水的质量,则n(H2O)==0.06mol,根据质量守恒:n(H)=2n(H2O)=0.12mol,
碱石灰增重的为二氧化碳的质量,n(CO2)==0.06mol,则n(C)=n(CO2)=0.06mol,
故有机物分子中C原子数目==3、H原子数目==6、
该有机物分子中含有C、H的总原子量为:12×3+1×6=42<58,说明其分子中一定含有O原子,
含有氧原子的O原子数目==1,
所以有机物分子式为C3H6O,
答:有机物的分子式为C3H6O.
点评 本题考查了有机物分子式的计算,题目难度中等,注意掌握质量守恒定律在确定有机物分子中的应用,正确判断有机物分子中是否含有氧元素为解答关键,还需要明确相对密度的含义.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
10.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液显碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等.则下列说法正确的是( )
| A. | 离子半径:丙>丁>乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均只有一种 |
8.已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价与W元素最高正价绝对值相等;工业上常用电解熔融氧化物的方法冶炼W单质;Z、W、R最高价氧化物对应的水化物两两反应均生成盐和水.下列说法正确的是( )
| A. | 简单离子半径:Y>Z>W | |
| B. | 简单氢化物的热稳定性:X>Y>R | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | R的最高价氧化物对应的水化物化学式一定是HRO4 |
15.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的正戊烷所含的分子数为0.5NA | |
| B. | 1 mol甲基中的电子数目为9NA | |
| C. | 28g乙烯所含共用电子对数目为4NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为NA |
12.下列物质属于共价化合物的是( )
| A. | H2O | B. | I2 | C. | NH4Cl | D. | CaCl2 |

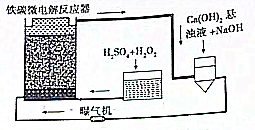 铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示.
铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示. 无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):
无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):