题目内容
15.下列关于${\;}_{2}^{3}He$的说法中正确的是( )| A. | ${\;}_{2}^{3}He$原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}He$原子核外有3个电子 | |
| C. | ${\;}_{3}^{4}He$原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}He$和${\;}_{2}^{4}He$是两种不同的核素 |
分析 原子符号左上角的数字为质量数,左下角的数字为质子数,原子中,质量数=质子数+中子数,质子数=核外电子数,据此解题.
解答 解:A.32He原子核内含有2个质子,中子数为3-2=1,故A错误;
B.32He原子核内含有2个质子,原子核外有2个电子,故B错误;
C.32He原子核内含有2个质子,故C错误;
D.32He和42He的质子数均为2,中子数不同,是两种不同的核素,故D正确.
故选D.
点评 本题考查核素,把握原子表示方法中不同位置数字的意义及原子中的数量关系为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
18.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16g CH4所含原子数目为NA | ||
| C. | 17gNH3所含中子数目为10 NA | D. | 20g重水(D2O)所含质子数目为10NA |
20.下列物质的沸点逐渐升高的是( )
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 | ||
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
7.某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:2Al-6e-═2Al3+;
总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:2Al-6e-═2Al3+;
总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
4.下列有关说法不正确的是( )
| A. | 要清洗附着在试管壁上的硫,可用的试剂是CS2 | |
| B. | 硫化亚铁溶于稀硝酸中反应的化学方程式为:FeS+2HNO3→Fe(NO3)2+H2S↑ | |
| C. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| D. | 在Na2SO3和BaCO3混合物中加入过量的稀硫酸,能产生气泡并有沉淀生成 |
5.从海水中提取的溴占世界溴年产量的$\frac{1}{3}$左右.已知溴水呈橙色,将SO2气体通入溴水可以使溴水褪色.下列有关叙述中正确的是( )
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
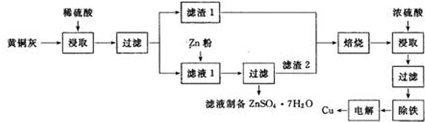 铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.
铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.