��Ŀ����
����Ŀ��һ���¶��£���10 mL 0.40 mol��L��1 H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�����(������Ϊ��״��)���±���ʾ��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
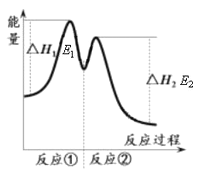
������ʾ����Ӧ���������У��� 2Fe3+��H2O2 == 2Fe2+��O2����2H+���� H2O2��2Fe2+��2H+ == 2H2O��2Fe3+����Ӧ�����������仯����ͼ��ʾ������˵���������
A. Fe3+�������������������ķֽ�����
B. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
C. ��Ӧ2H2O2(aq) == 2H2O(l)��O2(g)����H��E1��E2��0
D. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2)��3.33��10��2 mol��L��1��min��1
���𰸡�C
�������������ܷ�Ӧ![]() ,Fe3+�Ǵ����������������������ķֽ���������A��ȷ����Ӧ����������������ڷ�Ӧ������������ȷ�Ӧ����Ӧ�������������С�ڷ�Ӧ��������Ƿ��ȷ�Ӧ����B��ȷ���ʱ�=�����������������Ӧ�������������Ӧ2H2O2(aq) == 2H2O(l)��O2(g)����H
,Fe3+�Ǵ����������������������ķֽ���������A��ȷ����Ӧ����������������ڷ�Ӧ������������ȷ�Ӧ����Ӧ�������������С�ڷ�Ӧ��������Ƿ��ȷ�Ӧ����B��ȷ���ʱ�=�����������������Ӧ�������������Ӧ2H2O2(aq) == 2H2O(l)��O2(g)����H![]() E1��E2����C������0��6 min�������������ʵ�����0.001mol������H2O2�����ʵ�����
E1��E2����C������0��6 min�������������ʵ�����0.001mol������H2O2�����ʵ�����![]() 0.002mol������v(H2O2)��3.33��10��2 mol��L��1��min��1����D��ȷ��
0.002mol������v(H2O2)��3.33��10��2 mol��L��1��min��1����D��ȷ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���
ѡ�� | ʵ����� | ʵ��Ŀ�� |
A | ��ʢ��2mL0.1mo/LAgNO3��Һ���Թ��еμ�һ����0.1mo/LNaCl��Һ���������еμ�һ����0.1mol/LKI��Һ | ֤����ͬ�¶��µ��ܶȻ�����Ksp(AgCl)>Ksp(AgI) |
B | ȡ��֧�Թܣ��ֱ����4mL0.01mol/LKMnO4������Һ��Ȼ����һ֧�Թ��м���0.1mol/LH2C2O4Һ2mL������һ֧�Թ��м���0.1mol/L H2C2O4Һ4mL����¼��ɫʱ�� | ֤������Ũ��Խ��Ӧ����Խ�� |
C | ��ʢ��1mLŨ������Թ��м���5mL0.01mol/LK2Cr2O7��Һ | ֤�������������Ũ�ȣ�ʹƽ��Cr2O72-(��ɫ)+H2O |
D | �����BaCO3������NaOH��Һ��������֪Ũ�ȵ�����(�÷�̪��ָʾ��) | �ζ����е�NaOH���� |
A. A B. B C. C D. D