题目内容
【题目】在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(1),示意图如下:
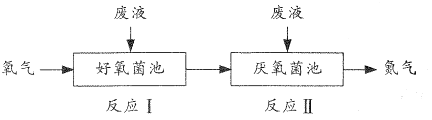
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) △H1=akJ·mol-1
反应Ⅱ:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) △H2=bkJ·mol-1
下列说法正确的是
A.两池发生的反应中,氮元素只被氧化
B.两池中投放的废液体积相等时,NH4+能完全转化为N2
C.常温常压下,反应Ⅱ中生成22.4 L N2转移的电子数为3.75NA
D.4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) △H=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
【答案】D
【解析】
A项、反应Ⅱ中铵根离子中氮元素被氧化,硝酸根中氮元素被还原,故A错误;
B项、由热化学方程式可知,反应I中1mol NH4+被氧气完全氧化能生成1mol NO3-,反应Ⅱ中1mol NH4+能氧化只能消耗0.6mol NO3-,则两池中投放的废液体积相等时,NH4+转化为NO3-和N2,故B错误;
C项、常温常压下,气体摩尔体积不是22.4L/mol,无法计算22.4 L N2的物质的量,不能计算反应转移的电子数,故C错误;
D项、由盖斯定律可知,![]() (3×I+Ⅱ)得热化学方程式4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ,则△H=
(3×I+Ⅱ)得热化学方程式4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ,则△H=![]() (3a+b) kJ·mol-1,故D正确;
(3a+b) kJ·mol-1,故D正确;
故选D。

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目