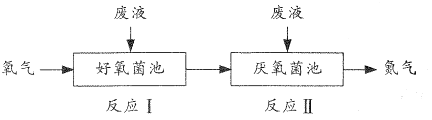
题目内容
【题目】如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:

(1)电源中Y极是____(填“正”或“负”)极,C中银电极发生的电极反应式是___
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,B中阳极发生的电极反应式___。溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=______。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解5 min后,共产生气体的体积为(标准状况)___,此时溶液c(OH-)=_____。
【答案】正 Ag-e-=Ag+ 4OH--4e-=O2 +2H2O 0.025mol.L-1 0.448L 0.1mol.L-1
【解析】
(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,可知X为电源的负极,从左到右六个电极名称分别是阴极、阳极、阴极、阳极、阴极、阳极;
(2)根据电极反应及电子守恒来计算通电前CuSO4溶液的物质的量;
(3)根据A中的电极反应及与C中转移的电子守恒来计算电解后溶液的氢离子的物质的量浓度。
(1)根据由铜电极的质量增加,则可以判断金属Cu电极为阴极,C中银电极是阳极,可知电源中Y极是正极。C中银电极发生的电极反应式是Ag-e-=Ag+;
(2)C中阴极反应为Ag++e-═Ag,n(Ag)=![]() =0.02mol,则转移的电子为0.02mol,B中阳极反应为4OH--4e-═2H2O+O2↑;则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=
=0.02mol,则转移的电子为0.02mol,B中阳极反应为4OH--4e-═2H2O+O2↑;则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=![]() =0.025 mol/L;
=0.025 mol/L;
(2)由A中发生2KCl+2H2O![]() 2KOH+H2+Cl2↑~2e-,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=
2KOH+H2+Cl2↑~2e-,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=![]() =0.1mol/L,溶液氢离子的物质的量浓度为10-13mol/L。
=0.1mol/L,溶液氢离子的物质的量浓度为10-13mol/L。