题目内容
【题目】(1)碱洗铝材除其表面的氧化膜,碱洗时常有气泡冒出,原因是___(用离子方程式表示)。为将碱洗后溶液中的铝以沉淀形式回收,最好应加入下列试剂中的___(填字母)。
a.稀H2SO4 b.盐酸 c.CO2 d.氨水 e.NaOH
(2)已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
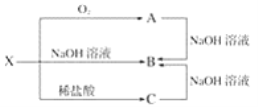
①写出下列物质的化学式:X:___,A:___,B:___,C:___。
②写出以下反应的离子方程式:A→B___;X→C:___。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ c Al Al2O3 NaAlO2 AlCl3 Al2O3+2OH-=2AlO2-+H2O 2Al+6H+=2Al3++3H2↑
【解析】
X即可以和碱反应,又可以和酸反应,故X是铝(Al),A是氧化铝(Al2O3),B是偏铝酸钠(NaAlO2),C是氯化铝(AlCl3),据此作答。
(1)铝单质可以和碱反应生成氢气:2Al+2OH-+2H2O=2AlO2-+3H2↑,碱洗后,铝元素主要以偏绿酸根的形式存在,在加入盐酸和硫酸等强酸时会先生成沉淀,当酸过量,沉淀会溶解,碱不和偏铝酸盐反应,故选用二氧化碳;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;c;
(2)①根据推断可知:X是铝(Al),A是氧化铝(Al2O3),B是偏铝酸钠(NaAlO2),C是氯化铝(AlCl3);
②A→B的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;X→C的离子方程式为:2Al+6H+=2Al3++3H2↑。

练习册系列答案
相关题目