题目内容
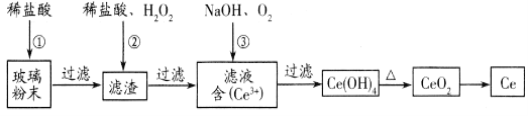
【题目】某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
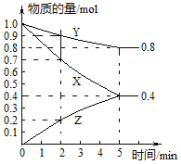
①该反应的化学方程式是______。
②0~2min时用X来表示该反应的平均速率为______。
③该反应达到平衡状态的标志是______ (填字母)。
A.X、Y的反应速率比为3∶1
B.Y的物质的量浓度在混合气体中保持不变
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
【答案】3X(g)+Y(g)![]() 2Z(g) 0.0375molL-1min-1 BC
2Z(g) 0.0375molL-1min-1 BC
【解析】
(1)5min内,X的物质的量从1.0mol减少到0.4mol,减少了0.6mol;Y的物质的量从1.0mol减少到0.8mol,减少了0.2mol;Z的物质的量从0mol增加到0.4mol,增加了0.4mol,故可以写出该反应的化学方程式为3X(g)+Y(g)![]() 2Z(g);
2Z(g);
(2)2min内,X减少了0.3mol,则X的反应速率v=![]() =
= =0.0375molL-1min-1;
=0.0375molL-1min-1;
(3)A选项为达到平衡状态时,X和Y的反应速率比也为3:1,A错误;B选项,随着反应的不断进行,Y的物质的量浓度减小,当达平衡时Y的物质的量浓度在混合气体中保持不变,B正确;C选项,随着反应的不断进行,气体总物质的量不断减小,当反应达平衡时,气体总物质的量不变,容器内压强不变,C正确;D选项,根据质量守恒定律,容器内总质量恒不变,D错误;E选项,无论反应时还是平衡时每消耗2molZ就生成1molY,E错误,故答案为BC。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目