题目内容
7.用PH=4和PH=11的强酸和强碱混合,使PH=10,则两溶液的体积比为多少?分析 pH=4的强酸溶液中c(H+)=10-4mol/L,pH=11的强碱溶液中c(OH-)=10-3mol/L,混合液的pH=10,则混合溶液中c(OH-)=10-4mol/L=$\frac{C(O{H}^{-}){V}_{碱}-C({H}^{+}){V}_{酸}}{{V}_{酸}+{V}_{碱}}$,据此计算酸碱体积之比.
解答 解:pH=4的强酸溶液中c(H+)=10-4mol/L,pH=11的强碱溶液中c(OH-)=10-3mol/L,混合液的pH=10,即混合后显碱性,故应根据c(OH-)的浓度来计算.
设强酸的体积为aL,强碱的体积为bL,
则有:混合溶液中c(OH-)=10-4mol/L=$\frac{C(O{H}^{-}){V}_{碱}-C({H}^{+}){V}_{酸}}{{V}_{酸}+{V}_{碱}}$=$\frac{1{0}^{-3}mol/L×bL-1{0}^{-4}mol/L×aL}{(a+b)L}$
解得a:b=9:2.
答:强酸和强碱的体积之比为9:2.
点评 本题考查了pH的简单计算,根据混合溶液中氢氧根离子浓度计算公式进行计算即可,注意溶液酸碱性与溶液pH的关系,题目难度不大.试题侧重基础知识的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究,实验过程如图,下列说法不正确的是( )

| A. | ①和②都是过滤操作 | |
| B. | 滤渣的成分是Cu和Fe的混合物 | |
| C. | 操作③和④都是在蒸发皿中进行 | |
| D. | 溶液B中反应的离子方程式:4Fe2++O2+8NH3+10H2O═8NH4++4Fe(OH)3↓ |
18.下列离子方程式书写正确的是( )
| A. | Cl2和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Fe加入CuSO4溶液:2Fe+3Cu2+═2Fe3++3Cu | |
| C. | AlCl3溶液中加入氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ |
2.具有下列电子层结构的基态原子或离子,其对应元素一定属于同一周期的是( )
| A. | 两种原子的电子层上全部都是s电子 | |
| B. | 原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子 | |
| C. | 最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子 | |
| D. | 3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子 |
12.向体积和物质的量浓度都相等的盐酸和氢氧化钠溶液中投入足量的铝粉,放出的氢气在同温同压下的体积之比为( )
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
16.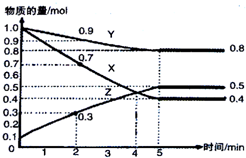 某温度时,在2L容器中X、Y、Z三种气态物质随时间的变化关系曲线如图所示.下列说法正确的是( )
某温度时,在2L容器中X、Y、Z三种气态物质随时间的变化关系曲线如图所示.下列说法正确的是( )
 某温度时,在2L容器中X、Y、Z三种气态物质随时间的变化关系曲线如图所示.下列说法正确的是( )
某温度时,在2L容器中X、Y、Z三种气态物质随时间的变化关系曲线如图所示.下列说法正确的是( )| A. | 反应开始到5min,用X表示的反应速率为0.3mol•L-1•min-1 | |
| B. | 反应开始到2min,用Z表示的反应速率为0.05mol•L-1•min-1 | |
| C. | 反应开始到4min反应达到平衡状态 | |
| D. | 反应的化学方程式为:2X(g)+Y(g)?3Z(g) |
17.下列反应中,属于吸热反应的是( )
| A. | Al与盐酸反应 | B. | 盐酸和NaOH溶液反应 | ||
| C. | 乙醇燃烧反应 | D. | Ba(OH)2•8H2O晶体与NH4Cl固体反应 |