题目内容
18.下列离子方程式书写正确的是( )| A. | Cl2和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Fe加入CuSO4溶液:2Fe+3Cu2+═2Fe3++3Cu | |
| C. | AlCl3溶液中加入氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ |
分析 A.反应生成盐酸和HClO,HClO在离子反应中保留化学式;
B.反应生成硫酸亚铁和Cu;
C.反应生成氢氧化铝和氯化铵;
D.反应生成氯化钙、水、二氧化碳.
解答 解:A.Cl2和水反应的离子反应为Cl2+H2O═H++Cl-+HClO,故A错误;
B.Fe加入CuSO4溶液的离子反应为Fe+Cu2+═Fe2++Cu,故B错误;
C.AlCl3溶液中加入氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误;
D.石灰石溶于稀盐酸的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应及分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
9. 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)$\stackrel{一定条件}{→}$CO(g)+3H2(g) I.
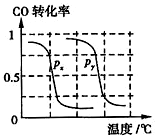
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH30H(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了右边的实验设计表中.
a.右表中剩余的实验条件数据:
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=0.1 MPa.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)$\stackrel{一定条件}{→}$CO(g)+3H2(g) I.
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH30H(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了右边的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=0.1 MPa.
6.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2?2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是( )
| A. | 2 mol SO2+1 mol O2 | B. | 4 mol SO2+1 mol O2 | ||
| C. | 2 mol SO2+1 mol O2+2 SO3 | D. | 3 mol SO2+1 SO3 |
13.下列反应中,不属于四种基本反应类型,也不属于氧化还原反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CO2+Ca(OH)2═CaCO3↓+H2O | ||
| C. | 2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$ 2H2O+O2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
3.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中加入NaHCO3 粉末,有气泡产生,说明氯水中含有H+ | |
| C. | 氯水能使有色花瓣褪色,说明氯水中含有Cl2 | |
| D. | 向氯水中滴加HNO3 酸化的AgNO3 溶液,产生白色沉淀,说明氯水中含有Cl- |
10.用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有三个峰,峰面积之比是1:1:6,则该化合物的结构简式为( )
| A. | CH3-O-CH2-CH3 | B. | 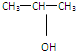 | C. | CH3CH2CH2OH | D. | C3H7OH |
8.将分别装有500ml0.5mol/L的下列溶液的四个电解池串联在同一电路中,用惰性电极电解,接通直流电源,当电路中有0.2mol的电子通过时,溶液pH值最小的是( )
| A. | KNO3溶液 | B. | AgNO3溶液 | C. | NaCl溶液 | D. | CuCl2溶液 |