题目内容
17.某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究,实验过程如图,下列说法不正确的是( )
| A. | ①和②都是过滤操作 | |
| B. | 滤渣的成分是Cu和Fe的混合物 | |
| C. | 操作③和④都是在蒸发皿中进行 | |
| D. | 溶液B中反应的离子方程式:4Fe2++O2+8NH3+10H2O═8NH4++4Fe(OH)3↓ |
分析 含硫酸亚铁和硫酸铜的工业废料,结合流程可知,过量还原性试剂A为Fe,置换出Cu,则操作①为过滤,滤渣中为Cu和过量的Fe;溶液B中主要含硫酸亚铁,通入空气和氨气,反应生成硫酸铵和氢氧化铁,操作②为过滤,固体为氢氧化铁,操作④为加热,生成红色的氧化铁;溶液C为硫酸铵溶液,则操作③为蒸发结晶得到硫酸铵晶体,据此答题.
解答 解:含硫酸亚铁和硫酸铜的工业废料,结合流程可知,过量还原性试剂A为Fe,置换出Cu,则操作①为过滤,滤渣中为Cu和过量的Fe;溶液B中主要含硫酸亚铁,通入空气和氨气,反应生成硫酸铵和氢氧化铁,操作②为过滤,固体为氢氧化铁,操作④为加热,生成红色的氧化铁;溶液C为硫酸铵溶液,则操作③为蒸发结晶得到硫酸铵晶体,
A、根据上面的分析可知,①和②都是过滤操作,故A正确;
B、滤渣中为Cu和过量的Fe,故B正确;
C、操作④为氢氧化铁固体加热,生成红色的氧化铁,应在坩埚中进行,故C错误;
D、溶液B中主要含硫酸亚铁,通入空气和氨气,反应生成硫酸铵和氢氧化铁,反应的离子方程式为:4Fe2++O2+8NH3+10H2O═8NH4++4Fe(OH)3↓,故D正确,
故选C.
点评 本题考查物质的性质、混合物的分离提纯及实验流程,把握流程中发生的反应及操作为解答的关键,侧重分析能力及知识综合应用能力的考查,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7.下列与金属腐蚀有关的说法正确的是( )
| A. |  图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 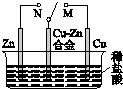 图中,开关由M改置于N时,Cu-Zn合金的腐蚀速率加快 | |
| C. | 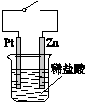 图中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 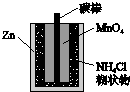 图中,Zn-MnO2干电池为一次性电池,将NH4Cl换成湿的KOH后电池性能更好 |
5.我们做了一系列关于Na2CO3和NaHCO3性质实验,根据你的实验观察和记录,下面关于Na2CO3和NaHCO3性质的结论,正确的是( )
| A. | 受热时Na2CO3比NaHCO3稳定 | |
| B. | 同温同压下,在水中Na2CO3比NaHCO3溶解性小 | |
| C. | Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应 | |
| D. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出的CO2多 |
12.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素为类铅元素.下面有关它的原子结构和性质预测正确的是( )
| A. | 类铅元素原子的最外层电子数为7 | B. | 其常见价态为+2、+4、+6 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小 |
2. 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变小 | |
| C. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 | |
| D. | 25℃时,该反应的平衡常数K=2.2 |
9. 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)$\stackrel{一定条件}{→}$CO(g)+3H2(g) I.
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH30H(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了右边的实验设计表中.
a.右表中剩余的实验条件数据:
n=150,m=$\frac{1}{3}$.
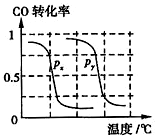
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=0.1 MPa.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)$\stackrel{一定条件}{→}$CO(g)+3H2(g) I.
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH30H(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了右边的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=0.1 MPa.
6.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2?2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是( )
| A. | 2 mol SO2+1 mol O2 | B. | 4 mol SO2+1 mol O2 | ||
| C. | 2 mol SO2+1 mol O2+2 SO3 | D. | 3 mol SO2+1 SO3 |