题目内容
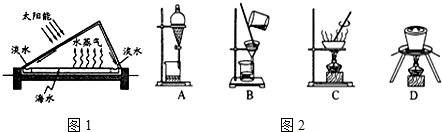
15.从海水中提取试剂级NaCl及回收金属Mg的工业流程如图:
(1)步骤I原理如图1,在实验室中完成该步骤所用装置为(如图2)中C(填序号).
(2)某学习小组设计了如图实验模拟步骤Ⅱ:

①该实验中加入Na2CO3的作用是除去钙离子、钡离子;若向粗盐溶液中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出.该反应的离子方程式为2CO32-+2Mg2++H2O=Mg2(OH)2C03↓+C02↑.
②学习小组发现上述实验即使BaCl2用量不足,第③步沉淀中依然含有少量BaCO3.试从平衡角度分析加入CO32-使BaSO4的溶解平衡向溶解方向移动,从而形成BaCO3.
③在第②步后增加过滤,并从滤渣中得到MgCl2•6H2O. 工业上通过电解获得Mg的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
若720℃时直接将MgCl2.6H2O熔融,然后用惰性电极电解,发现有固体剩余,则该固体可能是MgO(写化学式);现有ag滤渣,用上述方法处理回收Mg时产生标准状况下Cl2bL,剩余固体为cg.则滤渣中镁元素的质量分数为$\frac{\frac{24b}{22.4}+\frac{24c}{40}}{a}$×100%(不必化简).
分析 由分离流程可知,步骤I利用太阳能进行海水晒盐,与蒸发原理相同,步骤Ⅱ为粗盐溶解$→_{1}^{BaCl_{2}}$$→_{2}^{NaOH}$$→_{3}^{Na_{2}CO_{3}}$过滤$\stackrel{HCl}{→}$NaCl溶液,①除去硫酸根离子,②除去镁离子,③除去钙离子及过量的钡离子,最后加盐酸可除去过量的碳酸钠,注意除杂试剂均过量,以此来解答.
解答 解:(1)步骤I原理为蒸发,在实验室中完成该步骤所用装置为图2中C(蒸发),
故答案为:C;
(2)①该实验中加入Na2CO3的作用是除去钙离子、钡离子;若向粗盐溶液中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2C03生成,同时有气体逸出,气体为C02,该反应的离子方程式为2CO32-+2Mg2++H2O=Mg2(OH)2C03↓+C02↑,
故答案为:除去钙离子、钡离子;2CO32-+2Mg2++H2O=Mg2(OH)2C03↓+C02↑;
②第③步沉淀中依然含有少量BaCO3,是因为加入CO32-使BaSO4的溶解平衡向溶解方向移动,从而形成BaCO3,
故答案为:加入CO32-使BaSO4的溶解平衡向溶解方向移动,从而形成BaCO3;
③Mg为活泼金属,则工业上通过电解获得Mg的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,720℃时直接将MgCl2.6H20熔融,水解生成Mg(OH)2,然后分解生成固体MgO;滤渣中含MgCl2•6H2O,产生标况下Cl2bL,由MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑可知含Mg为$\frac{bL}{22.4L/mol}$×24g/mol=$\frac{24b}{22.4}$g,剩余固体为cg为MgO的质量,则含Mg为$\frac{24c}{40}$g,则滤渣中镁元素的质量分数为$\frac{\frac{24b}{22.4}+\frac{24c}{40}}{a}$×100%,
故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,MgO,$\frac{\frac{24b}{22.4}+\frac{24c}{40}}{a}$×100%;
点评 本题以海水资源的利用考查混合物分离提纯,为高频考点,把握流程中的反应及混合物分离方法为解答的关键,(2)中电解及计算为解答的难点,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 受热时Na2CO3比NaHCO3稳定 | |
| B. | 同温同压下,在水中Na2CO3比NaHCO3溶解性小 | |
| C. | Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应 | |
| D. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出的CO2多 |
| A. | 2 mol SO2+1 mol O2 | B. | 4 mol SO2+1 mol O2 | ||
| C. | 2 mol SO2+1 mol O2+2 SO3 | D. | 3 mol SO2+1 SO3 |
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中加入NaHCO3 粉末,有气泡产生,说明氯水中含有H+ | |
| C. | 氯水能使有色花瓣褪色,说明氯水中含有Cl2 | |
| D. | 向氯水中滴加HNO3 酸化的AgNO3 溶液,产生白色沉淀,说明氯水中含有Cl- |
| A. | CH3-O-CH2-CH3 | B. | 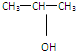 | C. | CH3CH2CH2OH | D. | C3H7OH |
| A. | 这六种元素可能全部是主族元素 | B. | Y一定是主族元素 | ||
| C. | M与Z的原子核外电子数相差18 | D. | Q的最高价氧化物一定能溶于强碱 |
| A. | NaHCO3→CO2→Na2CO3 | B. | Fe→FeCl2→FeCl3 | ||
| C. | SiO2→Na2SiO3→H2SiO3 | D. | Al2O3→A1(OH)3→NaAlO2 |