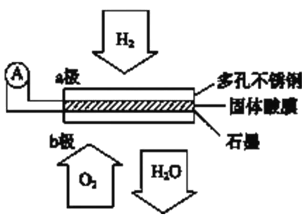
题目内容
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
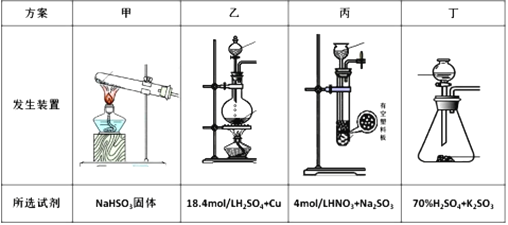
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子排布图是__________。
,其外围电子排布图是__________。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,价层电子排布式_________,在元素周期表中的位置是____________。
(3)C元素基态原子的电子排布图是下图中的____(填序号),另一个不能作为基态原子的电子排布图因为它不符合__(填序号)。
①
②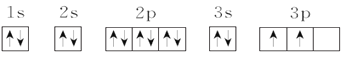
A.能量最低原理 B.泡利原理 C.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫作第一电离能(设为E)。如图所示:
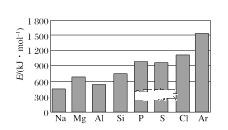
①同周期内,随着原子序数的增大,E值变化的总趋势是____;
②根据图中提供的信息,可推断出E氧____E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁___E钙。
(5)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、___________、____________。
【答案】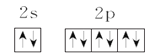 铬 3d54s1 第四周期 ⅥB族 ② C 增大 < > 平面正三角形 sp2 120°
铬 3d54s1 第四周期 ⅥB族 ② C 增大 < > 平面正三角形 sp2 120°
【解析】
(1)次外层电子数是最外层电子数![]() 的元素只能是氖,外围电子的电子排布图是
的元素只能是氖,外围电子的电子排布图是 ,故答案为:
,故答案为: ;
;
(2)136号元素,未成对电子数最多的元素外围电子排布为3d54s1,共有6个未成对电子,该元素是铬,处于周期表中第四周期第ⅥB族,故答案为:铬;3d54s1;第四周期ⅥB族;
(3)由电子排布图中的电子数知,C元素是硅,根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋方向相同,故硅元素基态原子的电子排布图为②;电子排布图①违背洪特规则,不能作为硅元素基态原子的电子排布图,则选C,故答案为:②;C;
(4)①由图可知,同周期内,随着原子序数的增大,E值变化的总趋势是增大,故答案为:增大;
②由图可知,同周期内,随着原子序数的增大,E值变化的总趋势是增大,但原子处于半满、全满时,能量较低,第一电离能高于同周期相邻元素,故E氧<E氟,故答案为:<;
③同主族金属性越强,第一电离能越小则E镁>E钙,故答案为:>;
(5) BCl3中心原子的价电子对数=![]() ,没有孤对电子,采取sp2杂化,空间构型为平面正三角形,共价键的键角为120°,故答案为:平面正三角形;sp2;120°。
,没有孤对电子,采取sp2杂化,空间构型为平面正三角形,共价键的键角为120°,故答案为:平面正三角形;sp2;120°。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为_____________,其固体的晶体类型为_____________。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为_____________(填化学式,下同),还原性由强到弱的顺序为____________,键角由大到小的顺序为_____________。
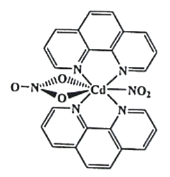
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有_________mol,该螯合物中N的杂化方式有__________种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标 原子 | x | y | z |
Cd | 0 | 0 | 0 |
Sn | 0 | 0 | 0.5 |
As | 0.25 | 0.25 | 0.125 |
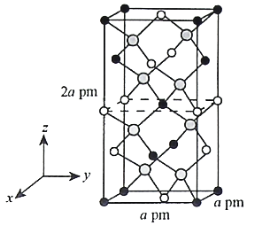
一个晶胞中有_________个Sn,找出距离Cd(0,0,0)最近的Sn_________(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有___________个。
【题目】短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
元素 | X | Y | Z | W |
最高价氧化物的水化物 | H3ZO4 | |||
| 1.00 | 13.00 | 1.57 | 0.70 |
A.元素电负性:Z<WB.简单离子半径:W<Y
C.元素第一电离能:Z<WD.简单氢化物的沸点:X<Z
【题目】如表列出了①~⑧八种元素在周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | |||||||
3 | ② | ③ | ④ | ⑤ | ⑦ | |||
4 | ⑥ | ⑧ |
请按要求回答下列问题:
(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是__(填写化学式)。
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为__(用元素符号表示)。
(3)元素③的原子结构示意图是__/span>。元素⑤的单质的导电性介于导体和绝缘体之间,因此是一种良好的__材料。
(4)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为___。
(5)用离子方程式证明⑦⑧两元素非金属性的强弱__。