题目内容
【题目】短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
元素 | X | Y | Z | W |
最高价氧化物的水化物 | H3ZO4 | |||
| 1.00 | 13.00 | 1.57 | 0.70 |
A.元素电负性:Z<WB.简单离子半径:W<Y
C.元素第一电离能:Z<WD.简单氢化物的沸点:X<Z
【答案】A
【解析】
四种短周期元素,均可以形成最高价氧化物对应的水化物。有H3ZO4可知,该酸为弱酸,则Z为P元素;0.1 molL1 W的最高价氧化物对应的水化物的pH为0.70,说明该物质为多元强酸,为硫酸,则W为S元素;0.1 molL1 Y的最高价氧化物对应的水化物的pH为13.00,说明该物质为一元强碱,为氢氧化钠,则Y为Na元素;0.1 molL1 X的最高价氧化物对应的水化物的pH为1.00,说明该物质为一元强酸,为硝酸,则Y为N元素,据此回答。
A.同一周期元素的电负性随着原子序数的递增而增大,因S的原子序数大于P,则S的电负性大于P,胡A正确;
B.电子层数越多离子半径越大,Na+有两个电子层而S2有三个电子层,因此S2的离子半径较大,故B错误;
C.同一周期元素原子的第一电离能总趋势为依次增大,但由于第ⅡA、ⅤA族元素的电子排布结构为全充满或半充满状态,原子结构较为稳定,故第ⅡA、ⅤA族元素的第一电离能较相邻两个主族的电离能较大,故P的第一电离能大于S,故C错误;
D.相对分子质量越大,物质的熔沸点越高,但由于X的氢化物NH3中含有分子间氢键,因此NH3的沸点高于PH3的沸点,故D错误;
综上所述,答案为A。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
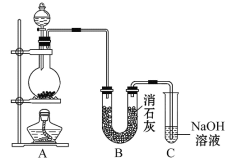
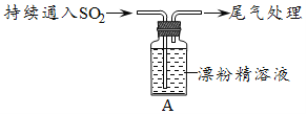
课堂练加测系列答案【题目】某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是___。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是___。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
A.用湿润的碘化钾淀粉试纸检验白雾,无变化;
B.用硝酸酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验A目的是___。
②由实验A、B不能判断白雾中含有HC1,理由是___。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是___。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是__。
②用离子方程式解释现象iii中黄绿色褪去的原因:__。