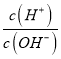题目内容
【题目】已知![]() 呈粉红色,
呈粉红色,![]() 呈蓝色,
呈蓝色,![]() 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:![]() ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
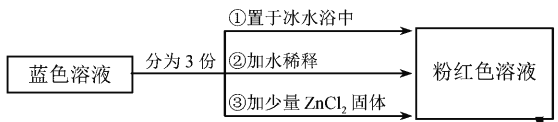
以下结论和解释正确的是
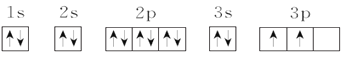
A.等物质的量的![]() 和
和![]() 中σ键数之比为3:2
中σ键数之比为3:2
B.由实验①可推知△H<0
C.实验②是由于c(H2O)增大,导致平衡逆向移动
D.由实验③可知配离子的稳定性:![]()
【答案】D
【解析】
A.1个[Co(H2O)6]2+中含有18个σ键,1个[CoCl4]2-中含有4个σ键,等物质的量的[Co(H2O)6]2+和[CoCl4]2-所含σ键数之比为18:4=9:2,A错误;
B. 实验①将蓝色溶液置于冰水浴中,溶液变为粉红色,说明降低温度平衡逆向移动,则逆反应为放热反应,正反应为吸热反应,H>0,B错误;
C. 实验②加水稀释,溶液变为粉红色,加水稀释,溶液的体积增大,[Co(H2O)6]2+、[CoCl4]2-、Cl-浓度都减小,[Co(H2O)6]2+、Cl-的化学计量数之和大于[CoCl4]2-的化学计量数,则瞬时浓度商>化学平衡常数,平衡逆向移动,C错误;
D. 实验③加入少量ZnCl2固体,溶液变为粉红色,说明Zn2+与Cl-结合成更稳定的[ZnCl4]2-,导致溶液中c(Cl-)减小,平衡逆向移动,则由此说明稳定性:[ZnCl4]2->[CoCl4]2-,D正确;
答案选D。

练习册系列答案
相关题目