题目内容
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
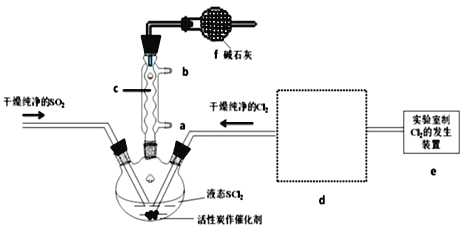
(1)仪器c的名称是___,装置f的作用是___。
(2)实验室制Cl2的化学方程式为____。
(3)SOCl2与水反应的化学方程式为___。
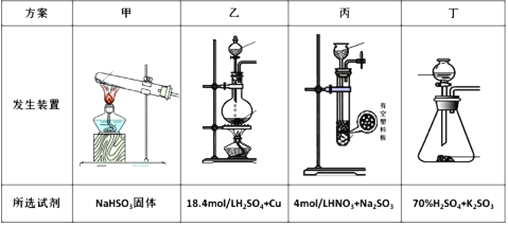
(4)下列四种制备SO2的方案中最佳选择是___。
(5)装置e中产生的Cl2经过d后进入三颈烧瓶,请在d的虚线框内画出所需实验装置图,并标出试剂___。
(6)试验结束后,将三颈烧瓶中混合物分离开的实验操作是___;(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl24.76g,则SOCl2的产率为___(注:用百分数形式表达,且保留三位有效数字)。
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是___。
【答案】球形冷凝管 吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解 MnO2+4HCl(浓)![]() MnCl2+Cl2↑ +2H2O SOCl2+H2O=SO2↑+2HCl↑; 丁
MnCl2+Cl2↑ +2H2O SOCl2+H2O=SO2↑+2HCl↑; 丁  蒸馏 50.0% 取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ
蒸馏 50.0% 取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ
【解析】
(1)根据装置图判断仪器名称,碱石灰与气体反应;
(2)实验室利用MnO2、4HCl(浓)制备氯气;
(3)SOCl2与水反应生成二氧化硫和氯化氢;
(4)丁中固体与液体反应制取二氧化硫比较合理,制取气体需要纯净,操作简单;
(5)装置e中产生的Cl2经过d后进入三颈烧瓶,d干燥氯气,且除去HCl;
(6)已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离,消耗氯气为![]() =0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,以此来解答;
=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,以此来解答;
(7)先加硝酸钡,且排除干扰离子,再加硝酸银观察是否生成白色沉淀检验氯离子。
(1)仪器c是球形冷凝管,f有两个作用一个是防止有毒的氯气与二氧化硫逸出,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解;
(2)实验室氯气制备的方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑ +2H2O;
MnCl2+Cl2↑ +2H2O;
(3)SOCl2与水反应生成二氧化硫和氯化氢,方程式为:SOCl2+H2O=SO2↑+2HCl↑;
(4)因为甲中加热亚硫酸氢钠确实会产生二氧化硫,但是同时也会生成水,所以试管不能向下倾斜,乙中18.4mol/L的硫酸太浓,其中水分过少硫酸仍然以分子形式存在,无法与铜反应制取二氧化硫;乙中无论是浓硝酸还是稀硝酸都具有很强的氧化性,可将亚硫酸钠中的+4价的硫氧化为+6价的硫酸根离子而无法得到二氧化硫,丁中反应生成硫酸钾与二氧化硫还有水,丁制取二氧化硫比较合理;
(5)装置e中产生的Cl2经过d后进入三颈烧瓶,d干燥氯气,且除去HCl,则d的虚线框内画出所需实验装置图,并标出试剂为: ;
;
(6)已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离.消耗氯气为![]() =0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为
=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为![]() ×100%=50%;
×100%=50%;
(7)向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,含亚硫酸根离子和氯离子,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置.取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案