题目内容
下列说法正确的是
| A.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.常温下等体积PH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多 |
| C.常温下,醋酸钠与醋酸的混合溶液pH=7:则c(Na+)> c(CH3COO-) |
| D.0.1mol·L-1NaHCO3溶液中:c(Na+)+c(H+)= c(HCO3-)+2 c(CO32-)+ c(OH-) |
AD
硫酸铵水解显酸性,A正确。醋酸是弱酸,再pH相等的条件下,醋酸的浓度大于盐酸的,所以醋酸消耗的氢氧化钠多,B不正确。根据电荷守恒c(Na+)+c(H+)= c(OH-)+ c(CH3COO-)可知,选项C中c(Na+)= c(CH3COO-)不正确。D符合电荷守恒,正确。答案选AD。

练习册系列答案
相关题目
 2Z(g) ,此反应达到平衡的标志是( )
2Z(g) ,此反应达到平衡的标志是( ) 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是
2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是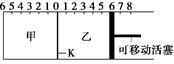
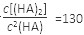 ,则反应向_______方向进行。
,则反应向_______方向进行。 (HA)2,已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是 。
(HA)2,已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是 。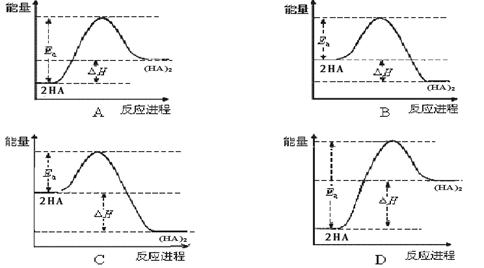
 CO(g)+3H2(g)
CO(g)+3H2(g) 2Fe +3CO2。下列说法正确的是( )
2Fe +3CO2。下列说法正确的是( )
 Y(g)+Z(s),以下能说明反应达到平衡标志的是
Y(g)+Z(s),以下能说明反应达到平衡标志的是 2NH3(g);ΔH=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、y的值为
2NH3(g);ΔH=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、y的值为 CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表: