题目内容
(12分)在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
(1)该反应的△H 0。(填“>”、“=”或“<”)。若到达平衡后升高温度,则CO2的转化率将 ,正反应速率 (填“增大”、“减小”或“不变”)。
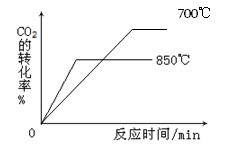
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。

(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 (填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
(4) 850℃时,在1L的密闭容器中分别充入2mol的CO2和H2,计算反应到达平衡时CO的物质的量浓度。(写出计算过程)
 CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:| 温度/℃ | 700 | 800 | 850 | 1000 | 1200 |
| 平衡常数K | 2.6 | 1.7 | 1 | 0.9 | 0.6 |
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。

(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 (填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
| | A | B | C | D | E |
| n(CO2)[ | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
(1)<,减小,增大(各1分)
(2)如下图(2分)(标注及拐点要明确)
(3)AD BD(每空2分)
(4) (5分)解:设平衡时CO的浓度为x
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
起始浓度(mol·L-1) 2 2 0 0
转化浓度(mol·L-1) x x x x
平衡浓度(mol·L-1)(2-x)(2-x) x x (2分)
则:K=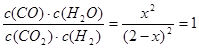 (1分)
(1分)
解得:x=1 即平衡时c(CO) =1 mol·L-1(2分)
(2)如下图(2分)(标注及拐点要明确)

(3)AD BD(每空2分)
(4) (5分)解:设平衡时CO的浓度为x
CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)起始浓度(mol·L-1) 2 2 0 0
转化浓度(mol·L-1) x x x x
平衡浓度(mol·L-1)(2-x)(2-x) x x (2分)
则:K=
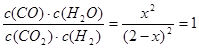 (1分)
(1分)解得:x=1 即平衡时c(CO) =1 mol·L-1(2分)
(1)反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K=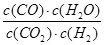 ,随温度升高而减小,说明平衡左移,正反应是放热反应,该反应的△H<0。若到达平衡后升高温度,则CO2的转化率将减小,正逆反应速率均增大。
,随温度升高而减小,说明平衡左移,正反应是放热反应,该反应的△H<0。若到达平衡后升高温度,则CO2的转化率将减小,正逆反应速率均增大。
(2)注意两点:一是温度越高,反应速率越大,越先达到平衡;再有降低温度,则CO2的转化率将增大。
(3)850℃时K=1,所以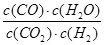 <1时,AD符合题意。
<1时,AD符合题意。
CO2(g)+H2(g) CO(g)+H2O(g)属于两边气体系数相等的可逆反应,依据等效平衡的判断标准可知,只需按照系数比转换为半边,反应物的物质的量比例相同即可,故答案为BD
CO(g)+H2O(g)属于两边气体系数相等的可逆反应,依据等效平衡的判断标准可知,只需按照系数比转换为半边,反应物的物质的量比例相同即可,故答案为BD
(4)见答案
 CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K=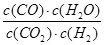 ,随温度升高而减小,说明平衡左移,正反应是放热反应,该反应的△H<0。若到达平衡后升高温度,则CO2的转化率将减小,正逆反应速率均增大。
,随温度升高而减小,说明平衡左移,正反应是放热反应,该反应的△H<0。若到达平衡后升高温度,则CO2的转化率将减小,正逆反应速率均增大。(2)注意两点:一是温度越高,反应速率越大,越先达到平衡;再有降低温度,则CO2的转化率将增大。
(3)850℃时K=1,所以
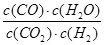 <1时,AD符合题意。
<1时,AD符合题意。CO2(g)+H2(g)
 CO(g)+H2O(g)属于两边气体系数相等的可逆反应,依据等效平衡的判断标准可知,只需按照系数比转换为半边,反应物的物质的量比例相同即可,故答案为BD
CO(g)+H2O(g)属于两边气体系数相等的可逆反应,依据等效平衡的判断标准可知,只需按照系数比转换为半边,反应物的物质的量比例相同即可,故答案为BD(4)见答案

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 CO(g)+Cl2(g) ΔH<0 下列有关说法正确的是( )
CO(g)+Cl2(g) ΔH<0 下列有关说法正确的是( ) N2O4(g) (正反应放热),若把容器置于100℃的沸水中,下列情况:①颜色、②气体平均相对分子质量、③质量、④压强、⑤密度中不变的是( )
N2O4(g) (正反应放热),若把容器置于100℃的沸水中,下列情况:①颜色、②气体平均相对分子质量、③质量、④压强、⑤密度中不变的是( )
 4C
4C 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是  2NH3(g) 达平衡的标志是
2NH3(g) 达平衡的标志是 H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( )
H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( ) 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )