题目内容
已知N2(g)+3H2(g) 2NH3(g);ΔH=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、y的值为
2NH3(g);ΔH=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、y的值为
 2NH3(g);ΔH=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、y的值为
2NH3(g);ΔH=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、y的值为| A.5,21 | B.3,13 | C.2,8 | D.1.5,6.5 |
A
考查等效平衡的判断。由于是等温等压下的平衡,所以只要满足氢气和氮气的物质的量之比是4︰1即可。即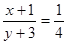 。又因为放出热量46.2kJ这说明反应中必须消耗氮气0.5mol,即生成氨气是1mol。因此平衡时容器中氨气的物质的量是3mol,所以最初氮气的物质的量是2mol×3=6mol,即x+1=6mol,所以x=5,则y=21,答案选A。
。又因为放出热量46.2kJ这说明反应中必须消耗氮气0.5mol,即生成氨气是1mol。因此平衡时容器中氨气的物质的量是3mol,所以最初氮气的物质的量是2mol×3=6mol,即x+1=6mol,所以x=5,则y=21,答案选A。
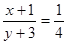 。又因为放出热量46.2kJ这说明反应中必须消耗氮气0.5mol,即生成氨气是1mol。因此平衡时容器中氨气的物质的量是3mol,所以最初氮气的物质的量是2mol×3=6mol,即x+1=6mol,所以x=5,则y=21,答案选A。
。又因为放出热量46.2kJ这说明反应中必须消耗氮气0.5mol,即生成氨气是1mol。因此平衡时容器中氨气的物质的量是3mol,所以最初氮气的物质的量是2mol×3=6mol,即x+1=6mol,所以x=5,则y=21,答案选A。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 H2(g)+CO(g)。
H2(g)+CO(g)。 2C在不同温度下的平衡常数:
2C在不同温度下的平衡常数: A+B的平衡常数为0.05,可推知t的范围是( )
A+B的平衡常数为0.05,可推知t的范围是( ) 2NH3(g)△H<0,向某体积恒定的密闭容器中按体积比1﹕3充入N2和 H2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化示意图,Y可以是( )
2NH3(g)△H<0,向某体积恒定的密闭容器中按体积比1﹕3充入N2和 H2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化示意图,Y可以是( )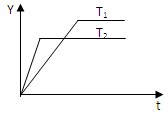
 CO(g)+Cl2(g) ΔH<0 下列有关说法正确的是( )
CO(g)+Cl2(g) ΔH<0 下列有关说法正确的是( ) N2O4(g) (正反应放热),若把容器置于100℃的沸水中,下列情况:①颜色、②气体平均相对分子质量、③质量、④压强、⑤密度中不变的是( )
N2O4(g) (正反应放热),若把容器置于100℃的沸水中,下列情况:①颜色、②气体平均相对分子质量、③质量、④压强、⑤密度中不变的是( ) H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( )
H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( )