题目内容
18.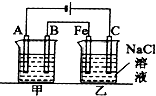 如图所示:甲、乙为相互串联的两电解池.试回答:
如图所示:甲、乙为相互串联的两电解池.试回答:(1)甲池若为电解精炼铜装置,则A电极名称为阴极,电极材料是精铜(或纯铜),电极反应式为Cu2++2e-=Cu,电解质溶液可以是CuSO4溶液或CuCl2溶液;
(2)乙池中Fe极电极反应式为2H++2e-=H2↑,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈红色;
(3)若甲池A极增重12.8g,则乙池C(石墨)极放出气体在标况下的体积为4.48L,电解后,若乙池剩余溶液为400mL,则溶液的pH=14.
分析 (1)依据电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,在阴极是溶液中铜离子得到电子生成铜;
(2)依据装置图分析可知,与电源正极相连的C电极为电解池的阳极,与电源负极连接的A电极是阴极,B为阳极,Fe为阴极;
(3)依据电极反应电子守恒计算甲池和乙池中电极产物的物质的量,乙池中依据氢离子和氢氧根离子守恒,水的离子积常数计算得到.
解答 解:(1)电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(CuSO4溶液或CuCl2溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e-═Cu,
故答案为:阴极;精铜(或纯铜); Cu2++2e-=Cu;CuSO4溶液或CuCl2溶液;
(2)依据装置图分析可知,与电源正极相连的C电极为电解池的阳极,与电源负极连接的A电极是阴极,B为阳极,Fe为阴极;Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e-═H2↑,破坏水的电离平衡氢氧根离子浓度增大,铁电极附近溶液变红色,
故答案为:2H++2e-=H2↑;红;
(3)甲池A为电解池的阴极,电极反应为Cu2++2e-═Cu,增重12.8g的铜物质的量为0.2mol,转移电子物质的量为0.4mol;
乙池C(石墨)极为电解池的阳极,电极反应为:2Cl--2e-═Cl2↑,依据电子守恒,生成氯气0.2mol,放出气体在标况下的体积为0.2mol×22.4L/mol=4.48L,Fe电极电解反应为:2H++2e-═H2↑,消耗氢离子物质的量0.4mol,依据水的电离氢离子和氢氧根离子守恒得到,生成氢氧根离子物质的量为0.4mol,c(OH-)=$\frac{0.4mol}{0.4L}$=1mol/L,溶液pH=14;
故答案为:4.48L;14.
点评 本题考查了电解原理,明确各个电极上放电的离子是解本题关键,再结合转移电子守恒进行计算,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 电池放电时,溶液中的阳离子移向正极 | |
| B. | 电池放电时,H2是正极 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,电池负极周围溶液的pH不断增大 |
| A. | 铁和盐酸:Fe+2H+═Fe3++H2↑ | |
| B. | 石灰石和硝酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜和硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| D. | 氢氧化钡溶液和硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | 用铜电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| B. | Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 硫酸氢钠溶液与Ba(OH)2溶液反应,pH=7:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| A. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2═NO3-+NO↑+H2O | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| C. | 燃烧法是研究确定有机物成分的有效方法 | |
| D. | 核磁共振氢常用于分析有机物的相对分子质量 |
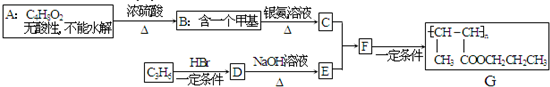
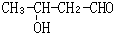 .
. 如图A是实验室制取某些气体的装置.
如图A是实验室制取某些气体的装置.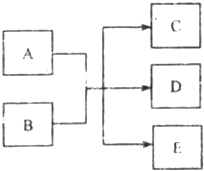 一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.