题目内容
9.如图所示,是由碳棒、铁片和氯化铜溶液组成的原电池,下列叙述正确的是( )
| A. | 碳棒为正极 | |
| B. | 碳棒上的电极反应式为2H2O+O2+4e-═4OH- | |
| C. | 铁片上的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 铁片为阴极 |
分析 由碳棒、铁片和氯化铜溶液组成的原电池中,Fe为负极,负极上Fe失电子生成亚铁离子,碳棒为正极,铜离子在正极上得电子生成Cu,据此分析.
解答 解:由碳棒、铁片和氯化铜溶液组成的原电池中,Fe为负极,负极上Fe失电子生成亚铁离子,碳棒为正极,铜离子在正极上得电子生成Cu,
A、碳棒为正极,故A正确;
B、碳棒上的电极反应式为Cu2++2e-═Cu,故B错误;
C、Fe上的电极反应式为Fe-2e-═Fe2+,故C错误;
D、原电池中只有正负极,不叫阴阳极,Fe为负极,不是阴极,故D错误;
故选A.
点评 本题考查了原电池的相关知识,题目难度不大,注意电极反应式的书写.

练习册系列答案
相关题目
18.某“84消毒液”的包装说明如下:
下列说法不正确的是( )
| 主要成分:25% NaClO、1000mL、密度1.198g•cm-3 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中CO2的变质 |
| A. | 该“84消毒液”的浓度为4.0mol•L-1 | |
| B. | 一瓶该“84消毒液”可能吸收CO2 44.8L(标况) | |
| C. | 稀释后的“84消毒液”中c(Na+)约为0.04 mol•L-1 | |
| D. | 若用NaClO 固体配制480mL含25%NaClO“84消毒液”,需要称量NaClO固体143g |
20.几种短周期元素的原子半径及主要化合价如下表( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 102 | 74 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| B. | X和Y的金属性X<Y | |
| C. | 气态氰化物的稳定性H2Z<H2W | |
| D. | ZW3通常用单质Z与单质W反应制备 |
17.下列过程属于人工固氮的是( )
| A. | 分离液态空气制氮气 | |
| B. | 闪电将空气中的N2转化成NO | |
| C. | 工业上合成氮 | |
| D. | 豆科植物将空气中的N2转化为化合态氮 |
4.工业上生产硫酸时,利用催化氧化反应将二氧化硫转化为三氧化硫是一个关键步骤,在密闭容器中压强及温度对SO2转化率(利用率)的影响如表:
(1)写出二氧化硫转化为三氧化硫的化学方程式2SO2+O2?2SO3. 根据表中数据可知,生成 SO3 的反应属于放热反应(填“放热”或“吸热”. )
(2)在其他条件不变的情况下,扩大容器体积以减小反应体系的压强,v正减小 (填“增大”或“减小”,下同),v逆减小,平衡向逆反应方向移动(选填“正反应”或“逆反应”).
(3)若容器容积为2L,开始加入SO2为0.20mol,10s后测得SO2 的物质的量为0.16mol,则O2的平均反应速率为0.001mol(L•S);若即系通入氧气,则平衡时的SO2转化率增大(选填“增大”或“减小”)
(4)在 400℃~500℃时,SO2 的催化氧化采用常压而不是高压,其主要原因是常压时的转化率较高、高压成本高.
| 转化率(%) | 0.1MPa | 0.5MPa | 1.0MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(2)在其他条件不变的情况下,扩大容器体积以减小反应体系的压强,v正减小 (填“增大”或“减小”,下同),v逆减小,平衡向逆反应方向移动(选填“正反应”或“逆反应”).
(3)若容器容积为2L,开始加入SO2为0.20mol,10s后测得SO2 的物质的量为0.16mol,则O2的平均反应速率为0.001mol(L•S);若即系通入氧气,则平衡时的SO2转化率增大(选填“增大”或“减小”)
(4)在 400℃~500℃时,SO2 的催化氧化采用常压而不是高压,其主要原因是常压时的转化率较高、高压成本高.
14.一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月.该电池反应为:2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,则有关说法正确的是( )
| A. | 充电时阴极发生氧化反应 | |
| B. | 放电时负极的电极反应为CH3OH+8OH--6e-═CO32-+6H2O | |
| C. | 通入0.25mol氧气并完全反应后,有1mol电子转移 | |
| D. | 放电时阴离子向正极移动 |
1.试推测该有机物CH3CH(OH)CH=CHCOOH不可能具有的性质是( )
| A. | 能与碳酸钠反应产生气体 | B. | 能被酸性高锰酸钾氧化 | ||
| C. | 能发生酯化反应 | D. | 能发生水解反应 |
18.苹果酸的结构简式为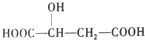 ,下列说法错误的是( )
,下列说法错误的是( )
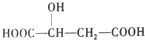 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 1mol苹果酸可与2 molNaOH发生中和反应 | |
| B. | -定条件下,苹果酸与乙酸或乙醇均能发生酯化反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 1mol苹果酸与足量金属Na反应生成1.5 molH 2 |
19.可逆反应在一定条件下达到化学平衡状态的标志是( )
| A. | 反应停止了 | B. | 正反应速率与逆反应速率相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率均为零 |