题目内容
【题目】氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式_________;
⑵NH2-的电子式为_________;
⑶N3-有_______个电子;
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式_________;
⑸等电子数的微粒往往具有相似的结构,试预测N3-的构型_________。
【答案】![]()
![]() 22 CO2、N2O 直线型
22 CO2、N2O 直线型
【解析】
(1)已知N2H62+有类似于NH4+的性质,结合铵根与碱反应产生氨气和水,可知N2H62+与碱反应产生N2H4和水,反应为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)NH2-的电子式为![]() ,故答案为
,故答案为![]() ;
;
(3)N3-每个氮原子7个电子,再加一个负电荷,电子数为22,故答案为:22;
(4)与N3-电子数相同的物质有CO2、N2O等,故答案为:CO2、N2O;
(5)N3-价电子数16,原子数为3,与CO2互为等电子体,故其结构与二氧化碳相同,为直线型,故答案为:直线型。

【题目】用试纸检验气体性质是一种重要的实验方法.如表所示的实验中![]() 可加热
可加热![]() ,下列试纸的选用、现象、对应结论都正确的一项是
,下列试纸的选用、现象、对应结论都正确的一项是![]()
序号 | 试剂B | 湿润的试纸A | 结论 |
A | 碘水 | 淀粉试纸变蓝 | 碘具有氧化性 |
B | 浓氨水、生石灰 | 蓝色石蕊试纸变红 | 氨气为碱性气体 |
C |
| 品红试纸褪色 |
|
D | Cu、浓硝酸 | 淀粉KI试纸变蓝 |
|
A.AB.BC.CD.D
【题目】加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
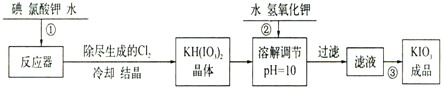
(1)已知步骤①反应器发生的反应为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,该反应的还原产物为___;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是___。
温度/℃ | 20 | 40 | 60 | 80 |
KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
(3)①已知:KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O,I2+2S2O32-=2I-+S4O62-,
测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是___mol·kg-1(以含w的代数式表示)。
②学生乙又进行了下列实验:
操作步骤 | 实验现象 |
取1g纯净的NaCl,加3mL水配制溶液 | 溶液无变化 |
滴入5滴淀粉溶液和1mL0.1mol·L-1KI溶液,振荡 | 溶液无变化 |
然后再滴入1滴1mol·L-1的H2SO4,从发振荡 | 溶液变蓝色 |
请推测实验中产生蓝色现象的可能原因,用离子方程式表示___。
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:___。
(4)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①根据上述实验现象,加碘盐中可能含有的物质中不能确定的是___。
②第二份试液中加入足量KI固体后,反应的离子方程式为___。
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
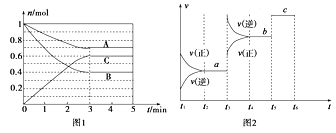
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
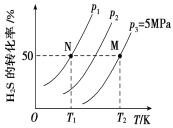
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。