题目内容
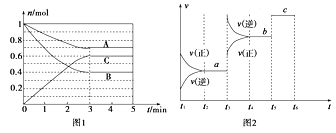
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
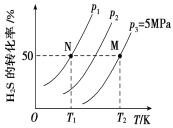
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。
【答案】A + 2B ![]() 2C 升高温度 a K1 > K2 = K3 > p3>p2>p1 1 及时分离出产物
2C 升高温度 a K1 > K2 = K3 > p3>p2>p1 1 及时分离出产物
【解析】
Ⅰ.(1)根据3min达到平衡时A、B、C的物质的量变化判断反应物、生成物,然后根据物质的量变化与化学计量数成正比写出反应的化学方程式;
(2)①t3时正逆反应速率同时增大,且逆反应速率大于正反应速率,说明平衡向着逆向移动,据此进行判断改变的反应条件;
②根据a、b、c三点A的转化率判断产物C的体积分数大小;
③化学平衡常数与温度有关,温度越高,平衡向着逆向移动,该反应的平衡常数减小;
Ⅱ.(1)恒压条件下,温度升高,H2S的转化率升高;
(2) 依据化学平衡移动原理可知压强增大平衡向气体体积减小的方向进行;
(3) 结合化学平衡三行计算列式计算平衡物质的物质的量,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;
(4) 如果想进一步提高H2S的转化率,除改变温度、压强外,可以减少生成物浓度促进平衡正向进行,提高硫化氢的转化率。
Ⅰ.(1)根据图象可知,达到平衡时A的物质的量减小了:1mol-0.7mol=0.3mol,B的物质的量减小为:1mol-0.4mol=0.6mol,C的物质的量增加,增加的物质的量为:0.6mol,所以A、B、C的物质的量变化之比为:0.3mol:0.6mol:0.6mol=1:2:3,该反应的化学方程式为:A+2B![]() 2C;
2C;
(2)①根据图象可知:t3时正逆反应速率同时增大,且逆反应速率大于正反应速率,说明平衡向着逆向移动,若增大压强,平衡向着正向移动,由于该反应为放热反应,升高温度后平衡向着逆向移动,所以t3时升高了温度;
②根据图象变化可知,在t1~t2时反应向着正向移动,A转化率逐渐增大,直至t2~t3时反应达到平衡状态,A转化率达到最大;而t3~t4时升高了温度,平衡向着逆向移动,A的转化率逐渐减小,直至t4~t5时A的转化率达到最低;而t5~t6时正逆反应速率同时增大且相等,说明平衡没有移动,A的转化率不变,与t4~t5时相等,所以A的转化率最大的时间段是:t2~t3,A的转化率最大时C的体积分数最大,此时间段为t2~t3,即为a点;
③反应A+2B2C △H<0,温度升高平衡向着逆反应方向移动,化学平衡常数减小,所以温度越高,化学平衡常数越小;t2~t3、t3~t4、t4~t5时间段的温度关系为:t3~t4=t4~t5>t2~t3,所以化学平衡常数大小关系为:K1>K2=K3。
Ⅱ. (1) 恒压条件下,温度升高,H2S的转化率升高,即升高温度平衡正向移动,则△H> 0;
(2) 2H2S(g)![]() 2H2(g)+S2(g) △H=+169.8kJmol-1,反应是气体体积增大的反应,温度不变,压强增大平衡逆向进行,H2S的转化率减小,则压强关系为:P1<P2<P3;
2H2(g)+S2(g) △H=+169.8kJmol-1,反应是气体体积增大的反应,温度不变,压强增大平衡逆向进行,H2S的转化率减小,则压强关系为:P1<P2<P3;
(3) M点的H2S转化率为50%,总压为5MPa,设H2S起始量为2mol,
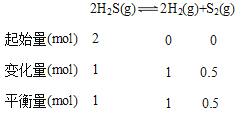
Kp=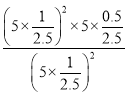 =1;
=1;
(4) 如果想进一步提高H2S的转化率,除改变温度、压强外,可以减少生成物浓度促进平衡正向进行,提高硫化氢的转化率,采取的措施有及时分离出产物。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成__________而使Cu2O产率降低。
(2)已知:①2Cu(s)+ ![]() O2(g)=Cu2O(s) ΔH1=-169 kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169 kJ·mol-1
②C(s)+ ![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+ ![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=________。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
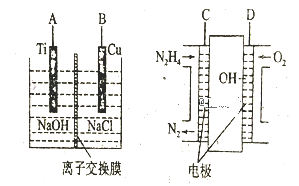
①上述装置中B电极应连_________电极(填“C”或“D”)。
②该离子交换膜为____离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为_______。
③原电池中负极反应式为______________。
【题目】Ⅰ. 在容积为5L的密闭容器中,通入5 mol N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3。则:
(1)2 min时,容器内n(N2)=________ ,c(H2)=___________。
(2)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 _______。
Ⅱ.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行