题目内容
【题目】下列有关试剂的保存方法, 错误的是
A.氢氟酸盛装在细口玻璃瓶中
B.氢氧化钠溶液装在用橡胶塞的试剂瓶中
C.硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
D.金属钠保存在煤油中
【答案】A
【解析】
A、氢氟酸与玻璃中![]() 反应而腐蚀玻璃瓶,应保存在塑料瓶中,故A错误;
反应而腐蚀玻璃瓶,应保存在塑料瓶中,故A错误;
B、玻璃中含有![]() ,易与氢氧化钠反应生成具有黏性的硅酸钠而使玻璃塞打不开,保存氢氧化钠溶液时不能用玻璃塞,应用橡皮塞,故B正确;
,易与氢氧化钠反应生成具有黏性的硅酸钠而使玻璃塞打不开,保存氢氧化钠溶液时不能用玻璃塞,应用橡皮塞,故B正确;
C、硫酸亚铁易被氧化生成硫酸铁,而铁能够还原硫酸铁使其成为硫酸亚铁,所以硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中可防止硫酸亚铁的变质,故C正确;
D、金属钠易与空气中氧气、水反应,与煤油不反应且密度比煤油小,保存在煤油中可隔绝空气,防止钠变质,故D正确;
故选A。

 阅读快车系列答案
阅读快车系列答案【题目】目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙![]() 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mol | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 |
| 2 | 4 |
| 8 |
乙 | 1 |
| 1 | 2 |
| 3 |
①T1℃时,该反应的平衡常数 ______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 ____![]() 填选项字母
填选项字母![]() .
.
A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入amolCO2(g)和bmolH2(g),反应达到平衡时,测得CO2的转化率大于![]() 的转化率,则
的转化率,则![]() 的值需满足的条件为 ______;
的值需满足的条件为 ______;
④丁容器的容积为1L,![]() 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______![]() 填选项字母
填选项字母![]() .
.
A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0mol、0mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示
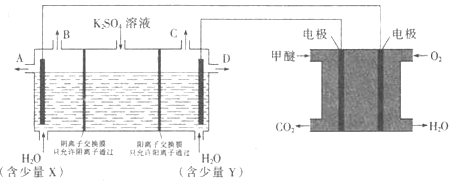
![]() 甲醚燃料电池的负极反应式为 ______
甲醚燃料电池的负极反应式为 ______
![]() 口导出的物质为 ______
口导出的物质为 ______![]() 填化学式
填化学式![]() .
.
![]() 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.
【题目】Ⅰ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | a | 2.0 | 2.0 | 5.2 |
3 | 3.0 | b | 2.0 | 1.0 | 6.4 |
(1)a=________,b=__________.根据上表中的实验数据,该组实验的结论_____________。
(2)①该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
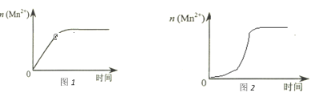
该小组同学提出的假设是___________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
固体X是__________。
③若该小组同学提出的假设成立,时间t__________4.0min(填>、=或<)。
Ⅱ.某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2、0.1mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母abcdef...表示)。
物理量 实验序号 | V/mL[0.1 mol·L-1 Fe2(SO4)3] | ||||
1 | a | ||||
2 | a |
________________________。
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成__________而使Cu2O产率降低。
(2)已知:①2Cu(s)+ ![]() O2(g)=Cu2O(s) ΔH1=-169 kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169 kJ·mol-1
②C(s)+ ![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+ ![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=________。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
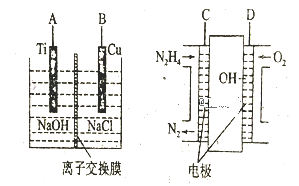
①上述装置中B电极应连_________电极(填“C”或“D”)。
②该离子交换膜为____离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为_______。
③原电池中负极反应式为______________。