题目内容
13.三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子.下列说法正确的是( )| A. | 在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl | |
| B. | NCl3跟水发生复分解反应的初级产物是NH3和HClO | |
| C. | NCl3发生水解反应生成NH4Cl、O2和Cl2 | |
| D. | NCl3的电子式应表示为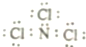 |
分析 A.在NCl3分子中N为-3价;
B.得电子能力强的元素的化合价往往显示负价,应生成氨气和HClO;
C.NCl3跟水反应过程是一个水解过程;
D、NCl3为共价化合物,分子中每个原子其最外层均达到8电子稳定结构,据此分析电子式;
解答 A、氮与氯的共用电子对偏向于氮原子,得电子能力N强于Cl原子,得电子能力强的N元素的化合价往往显示负价,水解反应的实质是氮离子和氢离子反应,氯离子和氢氧根离子结合,即在NCl3分子中N为-3价,NCl3跟水发生水解反应的产物是NH3和HClO,故A错误;
B、根据A的分析,NCl3跟水发生水解反应的产物是NH3和HClO,故B正确;
C、NCl3跟水反应过程是一个水解过程,水解反应的产物是NH3和HClO,故C错误;
D、三氯化氮分子中每个原子其最外层均达到8电子稳定结构,NCl3的电子式中氮原子少一对电子,故D错误;
故选B.
点评 本题涉及含氮化合物的性质以及原子得的得电子能力和元素化合价之间的关系知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意把握题给信息,难度不大.

练习册系列答案
相关题目
4.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④碱性:KOH>NaOH>Mg(OH)2
⑤酸性:H2SO4>HClO4>H2SeO4
⑥失电子能力:Na>Mg>Al.
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④碱性:KOH>NaOH>Mg(OH)2
⑤酸性:H2SO4>HClO4>H2SeO4
⑥失电子能力:Na>Mg>Al.
| A. | ①②④ | B. | ①③④ | C. | ②④⑥ | D. | ②⑤⑥ |
1.浓硫酸和浓硝酸是实验室常用的酸,下列关于它们的说法错误的是( )
| A. | 浓硫酸和浓硝酸都不能用来直接跟锌粒反应制氢气 | |
| B. | 浓硫酸和浓硝酸都能与金属铜反应 | |
| C. | 浓硫酸和浓硝酸加水稀释后都能与金属铜反应 | |
| D. | 浓硫酸和浓硝酸在常温下都能用金属铝或铁制容器盛放 |
8.假设x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是( )
| A. | ⅠB族 | B. | ⅢB族 | C. | ⅢA族 | D. | ⅡA族 |
18.为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是( )
| A. | Na2S2O3 | B. | AlCl3 | C. | Na2CO3 | D. | NaNO2 |

 H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题:
H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题: