题目内容
4.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④碱性:KOH>NaOH>Mg(OH)2
⑤酸性:H2SO4>HClO4>H2SeO4
⑥失电子能力:Na>Mg>Al.
| A. | ①②④ | B. | ①③④ | C. | ②④⑥ | D. | ②⑤⑥ |
分析 ①同周期元素随原子序数的增大,原子半径减小,具有相同电子排布的离子,原子序数的大的,半径小,阴离子的半径大于原子的半径;
②非金属性越强,气态氢化物的稳定性越强;
③非金属性越强,对应阴离子的还原性越弱;
④金属性越强,对应最高价氧化物的水化物的碱性越强;
⑤非金属性越强,对应最高价氧化物的水化物的酸性越强;
⑥元素的金属性越强,对应的单质的失电子能力越强.
解答 解:①同周期元素随原子序数的增大,原子半径减小,则S>Cl,具有相同电子排布的离子,原子序数的大的,半径小,则S2->Cl-,阴离子的半径大于原子的半径,S2->S,Cl->Cl,但无法确定Cl->S,故①错误;
②非金属性F>Cl>S>Se,气态氢化物的稳定性为HF>HCl>H2S>H2Se,故②正确;
③非金属性Cl>Br>I>S,对应离子的还原性为S2->I->Br->Cl-,故③错误;
④金属性K>Na>Mg,金属性越强,对应最高价氧化物的水化物的碱性越强,故④正确;
⑤非金属性Cl>S>Se,对应最高价氧化物的水化物的酸性为H4ClO4>H2SO4>H2SeO4,故⑤错误;
⑥金属性Na>Mg>Al,金属性越强,对应的单质的失电子能力越强,故⑥正确;
故选C.
点评 本题考查非金属元素的性质,为高频考点,明确同周期、同主族元素的性质变化规律及元素非金属性的比较方法是解答本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.化合物丙由如下反应得到: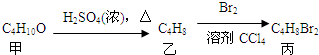 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )
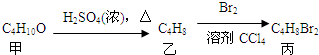 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )| A. | CH3CH2CHBrCH2Br | B. | CH3CH(CH2Br)2 | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
15.A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中:AC和BD盐溶液pH=7,BC盐溶液pH>7,则下列说法不正确的是( )
| A. | AD盐溶液pH>7 | B. | 在AC盐溶液中c(A+)+c(AOH)=c(C-)+c(HC) | ||
| C. | 酸的电离程度一定是:HD>HC | D. | 碱的电离程度一定是:AOH>BOH |
12.下列排列顺序正确的是( )
| A. | 热稳定性:H2O>H2S>SiH4 | B. | 原子半径:Na>N>Al | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 碱性:NaOH>Be(OH)2>Mg(OH)2 |
9.将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是( )
| A. | Br2 (蒸气) | B. | NH3 | C. | C12 | D. | CO2 |
16.下列气体溶于水,发生氧化还原反应的是( )
| A. | SO2溶解于水 | B. | CO2溶解于水 | C. | NO2溶解于水 | D. | NH3溶解于水 |
13.三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子.下列说法正确的是( )
| A. | 在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl | |
| B. | NCl3跟水发生复分解反应的初级产物是NH3和HClO | |
| C. | NCl3发生水解反应生成NH4Cl、O2和Cl2 | |
| D. | NCl3的电子式应表示为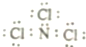 |
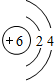 ,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.
,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯. 反应时断裂的化学键是( )
反应时断裂的化学键是( )