题目内容
18. H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题:
H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题: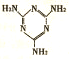
(1)一种由氢,碳,氧,氨形成的化合物-三聚氰胺,其结构简式如图,它是一种用途广泛的基本有机化合物原料.
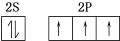
①写出其中基态氮原子的价电子排布图
②三聚氰胺分子中氮原子杂化轨道类型是sp3、sp2
③NH4+离子的空间构型为正四面体.
(2)金属Cr广泛用于航空宇航,电器及仪器等工业部门.
①Cr在周期表中属于d区元素.Cr的电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1)
②Cr可形成配合物K[Cr(C2O4)2(H2O)2],配体是C2O42-、H2O,与CO互为等电子体的分子是(填化学式)N2.
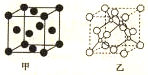
③与Cr同周期且最外层电子数相同的一种金属R的晶胞结构如图所示,R的配位数为12.R的某种氯化物的晶胞结构如图乙所示,则该氯化物的化学式是CuCl,若R与Cl原子最近的距离为apm,则该晶体的密度为$\frac{597\sqrt{3}×1{0}^{30}}{32{a}^{3}{N}_{A}}$g•cm+3(阿伏伽德罗常数的数值用NA表示).
分析 (1)①氮元素是7号元素,最外层有5个电子,根据核外电子排布规律可画出价电子排布图;
②三聚氰胺分子中氨基上的氮能形成三个共价和一对孤电子对,杂环上的氮原子形成两个共价键和一对孤电子对;
③NH4+中氮原子的价层电子对数为$\frac{5+4-1}{2}$=4,氮原子的杂化方式为sp3,氮原子周围有4个共价键;
(2)①Cr为24号元素,据此判断在周期表中位置和书写电子排布式;
②在配合物中提供孤电子对的为配体,等电子体为原子数和价电子数都相等的微粒;
③与Cr同周期且最外层电子数相同的一种金属R为Cu,根据晶胞图可知,Cu的晶胞为面心立方结构,根据Cu的某种氯化物的晶胞图,利用均摊法可计算出晶胞中所含原子数,进而确定化学式,根据$ρ=\frac{m}{V}$可计算得密度;
解答 解:(1)①氮元素是7号元素,最外层有5个电子,根据核外电子排布规律可画出价电子排布图为 ,
,
故答案为: ;
;
②三聚氰胺分子中氨基上的氮能形成三个共价和一对孤电子对,所以该氮原子是按sp3方式杂化,杂环上的氮原子形成两个共价键和一对孤电子对,该氮原子是按sp2方式杂化,
故答案为:sp3、sp2;
③NH4+中氮原子的价层电子对数为$\frac{5+4-1}{2}$=4,氮原子的杂化方式为sp3,氮原子周围有4个共价键,所以的空间构型为正四面体,
故答案为:正四面体;
(2)①Cr为24号元素,位于周期表中d区,其电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1),
故答案为:d;1s22s22p63s23p63d54s1(或[Ar]3d54s1);
②在配合物K[Cr(C2O4)2(H2O)2]中,C2O42-和H2O都提供孤电子对,所以都为配体,与CO互为等电子体的分子是N2,
故答案为:C2O42-、H2O;N2;
③与Cr同周期且最外层电子数相同的一种金属R为Cu,根据晶胞图可知,Cu的晶胞为面心立方结构,以顶点上的Cu为例,每个R原子周围距离最近的Cu原子分布中经过该点的面的面心上,有12个,根据Cu的某种氯化物的晶胞图,对比甲乙两图可知,乙图中大球为R原子,小球为氯原子,利用均摊法可知,晶胞中所含Cu原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,氯原子数为4,r所以化学式为CuCl,Cu与Cl原子最近的距离为apm,则晶胞的体对角线长度为4apm,所以晶胞的边长为$\frac{4a}{\sqrt{3}}$pm,根据$ρ=\frac{m}{V}$可知,晶体的密度为$\frac{\frac{4×(64+35.5)}{{N}_{A}}}{(\frac{4a}{\sqrt{3}}×1{0}^{-10})^{3}}$g•cm-3=$\frac{597\sqrt{3}×1{0}^{30}}{32{a}^{3}{N}_{A}}$g•cm-3,
故答案为:12;CuCl;$\frac{597\sqrt{3}×1{0}^{30}}{32{a}^{3}{N}_{A}}$;
点评 本题考查电子排布图、电子排布式、原子的杂化、微粒的空间构型、晶体的结构及晶胞计算,需要学生具有一定的空间想象与数学计算能力,难度较大.

| A. | 在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl | |
| B. | NCl3跟水发生复分解反应的初级产物是NH3和HClO | |
| C. | NCl3发生水解反应生成NH4Cl、O2和Cl2 | |
| D. | NCl3的电子式应表示为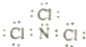 |
| A. | 离子半径:X+>Y- | |
| B. | Z元素的最高正化合价与最低负化合价代数和为4 | |
| C. | X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 | |
| D. | Y的氢化物中存在离子键 |
| A. | 若混合后溶液pH=7,则c(NH4+)=c(Cl-) | |
| B. | 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 若混合后溶液满足c(H+)=c(OH-)+c(NH3•H2O),则可推出a=1 |
| A. | 该反应中氧化剂是Cl2 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 上述反应中,每生成l mol SO42-,转移4 mol电子 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂 |
| A. | Na3N与盐酸反应时只生成一种盐NaCl | |
| B. | 在Na3N与水反应中Na3N是还原剂 | |
| C. | Na3N分子中Na+的半径比N3-的半径小 | |
| D. | Na+与N3-的电子层都与氩原子的结构相同 |
| A. | 洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所 | |
| B. | 加强工业废水的排放监控,坚持达标排放 | |
| C. | 合理施用农药、化肥,以减少水体污染 | |
| D. | 淡水资源丰富,所以淡水可以取之不尽、用之不竭 |
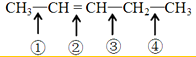 反应时断裂的化学键是( )
反应时断裂的化学键是( )