题目内容
18.为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是( )| A. | Na2S2O3 | B. | AlCl3 | C. | Na2CO3 | D. | NaNO2 |
分析 根据提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化来分析.
解答 解:A.提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化,还原性:S2O32->I-,则可以选Na2S2O3作稳定剂,故A正确;
B.AlCl3,水解后呈酸性,且还原性I->Cl-,所不能作稳定剂,故B错误;
C.3I2+6OH-═IO3-+5I-+3H2O,I2与OH-会发生反应生成IO3-和5I-,即在碱性条件下I-不易被氧化,Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,故C正确;
D.NaNO2当遇强还原性物质时能表现出氧化性,则NaNO2与KI能发生氧化还原反应为2NO2-+2I-+4H+=2NO↑+I2+2H2O,所以不能作稳定剂,故D错误;
故选AC.
点评 本题考查了氧化还原反应,题目难度吧不大,注意根据碘离子想性质分析,侧重于考查学生的分析能力.

练习册系列答案
相关题目
8.下列一卤代烷不能发生消去反应的是( )
| A. | CH3CH2Cl | B. | (CH3)3CCH2Cl | C. | (CH3)3CCl | D. | (CH3)2CHCl |
9.将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是( )
| A. | Br2 (蒸气) | B. | NH3 | C. | C12 | D. | CO2 |
6.下列情况会对人体健康造成较大危害的是( )
| A. | 自来水中通入少量Cl2进行消毒杀菌 | |
| B. | 用SO2漂白食品 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢 | |
| D. | 用小苏打(NaHCO3)发酵面团制作馒头 |
13.三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子.下列说法正确的是( )
| A. | 在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl | |
| B. | NCl3跟水发生复分解反应的初级产物是NH3和HClO | |
| C. | NCl3发生水解反应生成NH4Cl、O2和Cl2 | |
| D. | NCl3的电子式应表示为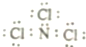 |
3.现有部分短周期元素的性质或原子结构如下表:
下列有关说法中正确的是( )
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 元素的非金属性:Z>T>X | |
| B. | 最高价氧化物对应水化物的酸性:T>Z | |
| C. | 气态氢化物的热稳定性:X>Y | |
| D. | 四种元素中原子半径最大的是Z |
10.向0.15 mol Cu粉与Fe的混合物中加入一定量的稀硫酸产生气体 X L,然后加入一定量的稀硝酸,充分反应后固体全部溶解,收集到NO气体 Y L,(气体体积均已换算到标准状况).则X+Y的数值可能是( )
| A. | .1.12 | B. | 2.24 | C. | 2.8 | D. | 4.48 |
3.常温下,将100mL 1mol•L-1 的氨水与100mL amol•L-1盐酸等体积混合,忽略反应放热和体积变化,下列有关推论不正确的是 ( )
| A. | 若混合后溶液pH=7,则c(NH4+)=c(Cl-) | |
| B. | 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 若混合后溶液满足c(H+)=c(OH-)+c(NH3•H2O),则可推出a=1 |