题目内容
2.pH=10的NaOH溶液与pH=12的NaOH溶液以1:2体积混合,则混合后所得溶液的pH约为11.7.分析 25℃时,KW=c(H+)•c(OH-)=10-7×10-7=10-14,两种碱溶液混合,先计算出混合后溶液的c(OH-),再根据溶液的Kw计算出溶液的c(H+),然后根据PH=-lg(c(H+)求PH值.
解答 解:25℃时,KW=c(H+)•c(OH-)=10-7×10-7=10-14,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,pH=12的NaOH溶液中c(OH-)=1×10-2mol/L,混合后c(OH-)=$\frac{1{0}^{-4}+1{0}^{-2}}{2}$mol/L≈$\frac{1{0}^{-2}}{2}$mol/L,
则溶液中的c(H+)=$\frac{{K}_{W}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{\frac{1{0}^{-2}}{2}}$mol/L=2.0×10-12mol/L,所以PH=12-lg2=11.7,
故答案为:11.7.
点评 本题考查两种碱溶液混合后的溶液氢离子浓度计算,题目难度不大,注意先计算溶液中c(OH-),再计算c(H+).

练习册系列答案
相关题目
12.下列排列顺序正确的是( )
| A. | 热稳定性:H2O>H2S>SiH4 | B. | 原子半径:Na>N>Al | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 碱性:NaOH>Be(OH)2>Mg(OH)2 |
13.三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子.下列说法正确的是( )
| A. | 在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl | |
| B. | NCl3跟水发生复分解反应的初级产物是NH3和HClO | |
| C. | NCl3发生水解反应生成NH4Cl、O2和Cl2 | |
| D. | NCl3的电子式应表示为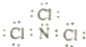 |
10.向0.15 mol Cu粉与Fe的混合物中加入一定量的稀硫酸产生气体 X L,然后加入一定量的稀硝酸,充分反应后固体全部溶解,收集到NO气体 Y L,(气体体积均已换算到标准状况).则X+Y的数值可能是( )
| A. | .1.12 | B. | 2.24 | C. | 2.8 | D. | 4.48 |
17.根据有机物的性质,完成下表
| 有机物 | 加入试剂 | 预期现象 |
| (1)甲苯 | 酸性高锰酸钾 | |
| (2)苯乙烯 | 溴水 | |
| (3)苯酚 | 呈紫色 | |
| (4)葡萄糖 | 出现红色沉淀 | |
| (5)淀粉 | 碘水 | |
| (6)鸡蛋清 | 浓硝酸 |
6.周期表中前20号元素X、Y、Z.已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子.下列有关说法正确的是( )
| A. | 离子半径:X+>Y- | |
| B. | Z元素的最高正化合价与最低负化合价代数和为4 | |
| C. | X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 | |
| D. | Y的氢化物中存在离子键 |
7.Na3N是离子化合物,它能与水反应生成氨气.以下关于Na3N的说法中正确的是( )
| A. | Na3N与盐酸反应时只生成一种盐NaCl | |
| B. | 在Na3N与水反应中Na3N是还原剂 | |
| C. | Na3N分子中Na+的半径比N3-的半径小 | |
| D. | Na+与N3-的电子层都与氩原子的结构相同 |
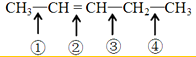 反应时断裂的化学键是( )
反应时断裂的化学键是( )