题目内容
17.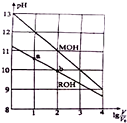 常温下,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
常温下,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )| A. | MOH的碱性强于ROH的碱性 | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 若两溶液无限稀释,则它们的c(OH-)相等 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$不变 |
分析 A.相同浓度的一元碱,碱的pH越大其碱性越强;
B.弱电解质在水溶液中随着浓度的减小其电离程度增大;
C.若两种溶液无限稀释,最终其溶液中c(OH-)接近于纯水中c(OH-);
D.MOH的碱性强于ROH的碱性,当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,促进弱电解质电离.
解答 解:A.相同浓度的一元碱,碱的pH越大其碱性越强,根据图知,未加水时,相同浓度条件下,MOH的pH大于ROH的pH,说明MOH的电离程度大于ROH,则MOH的碱性强于ROH的碱性,故A正确;
B.由图示可以看出ROH为弱碱,弱电解质在水溶液中随着浓度的减小其电离程度增大,b点溶液体积大于a点,所以b点浓度小于a点,则ROH电离程度:b>a,故B正确;
C.若两种溶液无限稀释,最终其溶液中c(OH-)接近于纯水中c(OH-),所以它们的c(OH-)相等,故C正确;
D.根据A知,碱性MOH>ROH,当lg$\frac{V}{{V}_{0}}$=2时,由于ROH是弱电解质,升高温度能促进ROH的电离,所以c(M+)/c(R+)减小,故D错误;
故选D.
点评 本题考查弱电解质在水溶液中电离平衡,为高频考点,明确弱电解质电离特点、弱电解质电离程度与溶液浓度关系等知识点是解本题关键,易错选项是C,注意:碱无论任何稀释都不能变为中性溶液或酸性溶液,接近中性时要考虑水的电离,为易错点.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
7.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+、Ca2+、CO32-、Cl- | B. | H+、Fe2+、NO3-、OH- | ||
| C. | K+、Na+、Cl-、OH- | D. | Cu2+、Ba2+、Cl-、SO42- |
8.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.I配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则需要称量NaOH固体质量为:5.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):abe.
(1)若实验中大约要使用245mL NaOH溶液,则需要称量NaOH固体质量为:5.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
5.室温下,向pH=13的氢氧化钡溶液中加入等体积的下列溶液后,滴入石蕊试液,出现蓝色,该溶液可能是( )
| A. | 0.05 mol•L-1的硫酸溶液 | B. | 0.1 mol•L-1的硫酸钠溶液 | ||
| C. | pH=1的醋酸溶液 | D. | pH=1的盐酸 |
12.下列关于实验现象的描述不正确的是( )
| A. | 把Cu片和Fe片紧靠在一起浸入稀硫酸中,Cu片表面出现气泡 | |
| B. | 用铜片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层铜 | |
| C. | 把Cu片浸入FeCl3溶液中,在Cu片表面出现一层铁 | |
| D. | 把Zn粒放入装有稀盐酸的试管中,加入几滴CuCl2溶液,放出气泡的速率减慢 |
9.下列说法中正确的是( )
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 1mol O2所占的体积为22.4L | |
| C. | 1mol任何气体所含的分子个数都是相同的 | |
| D. | 相同质量的N2和CO占有相同的体积 |
7.下列离子反应不能发生的是( )
| A. | CaCO3+H2O+CO2═Ca(HCO3)2 | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | Na2CO3+Ca(OH)2═CaCO3↓+2NaOH | D. | KCl+NaOH═NaCl+KOH |