题目内容
5.已知R原子有b个中子,R2+核外有a个电子.表示R原子符号正确的是( )| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
分析 阳离子中,质子数=核外电子数+电荷数,质量数=质子数+中子数,根据质子数和质量数书写原子符号.
解答 解:R2+离子核外有a个电子,质子数=核外电子数+电荷数=a+2,质量数=质子数+中子数=a+2+b,所以R原子符号为a+2a+b+2R,
故选C.
点评 本题考查质子数、中子数和质量数之间的关系,难度不大,要注意原子符号的意义.

练习册系列答案
相关题目
15.下列混合物应选用蒸馏操作法分离的是( )
| A. | 硝酸钾和氯化钠的混合物 | B. | 溴水 | ||
| C. | 汽油和柴油 | D. | 四氯化碳和水 |
16.下表是短周期中部分元素的原子半径及主要化合价.请回答:
(1)Z单质与Y的最高价氧化物对应水化物的浓溶液加热反应可生成一种红棕色气体,则反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)实验室制取YW3的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)R2X2与W2X反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(4)写出铁在高温下与W2X反应生成磁性物质并产生W2气的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
(5)由W,R,X三种元素形成的离子化合物是强碱,写出它与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
(2)实验室制取YW3的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)R2X2与W2X反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(4)写出铁在高温下与W2X反应生成磁性物质并产生W2气的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
(5)由W,R,X三种元素形成的离子化合物是强碱,写出它与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
13.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
| A. | 能够提高化学反应速率 | B. | 能够提高产品的产量 | ||
| C. | 能够提高经济效益 | D. | 能够节约原料和能源 |
17.在5L的密闭容器中进行下述反应:4NH3+5O2=═4NO+6H20,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是( )
| A. | V(O2 )=0.01mol•L-1•s-1 | B. | V(NO )=0.08mol•L-1•s-1 | ||
| C. | V(H2O)=0.01mol•L-1•s-1 | D. | V(NH3)=0.002mol•L-1•s-1 |
14.某烷烃的式量为72,跟Cl2反应生成的一卤代物只有一种,该烷烃是( )
| A. | 戊烷 | B. | 乙烷 | C. | 2-甲基丁烷 | D. | 2,2-二甲基丙烷 |
15.下列关于碱金属元素和卤素的说法中,错误的是( )
| A. | 钾与水的反应比钠与水的反应更剧烈 | |
| B. | 溴单质与水的反应比氯单质与水的反应更剧烈 | |
| C. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| D. | 碱金属元素中,锂原子失去最外层电子的能力最弱 |

 或
或  .
. ,由两种元素组成的三原子共价化合物的电子式
,由两种元素组成的三原子共价化合物的电子式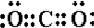 或
或 .(各写1种)
.(各写1种)