题目内容
6.某有机物的结构简式为CH2=CHCH2-CH2OH,下列对其化学性质的判断中,不正确的( )| A. | 一定条件下能发生加聚反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 该有机物能发生加成反应但不能发生催化氧化生成醛 | |
| D. | 1mol该有机物能与足量的金属钠反应放出0.5mol H2 |
分析 CH2=CHCH2OH含有碳碳双键和醇羟基,所以应具有烯烃和醇的性质,能发生加成反应、氧化反应、酯化反应、取代反应.
解答 解:A.含有碳碳双键,可发生加聚反应,故A正确;
B.含有碳碳双键,可发生氧化反应,故B正确;
C.含有羟基,为伯醇,可发生催化氧化生成醛,故C错误;
D.含有1个羟基1mol该有机物能与足量的金属钠反应放出0.5mol H2,故D正确.
故选C.
点评 本题考查有机物的结构与性质,注意把握有机物中的官能团,熟悉烯烃、醇的性质即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
16.下表是短周期中部分元素的原子半径及主要化合价.请回答:
(1)Z单质与Y的最高价氧化物对应水化物的浓溶液加热反应可生成一种红棕色气体,则反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)实验室制取YW3的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)R2X2与W2X反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(4)写出铁在高温下与W2X反应生成磁性物质并产生W2气的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
(5)由W,R,X三种元素形成的离子化合物是强碱,写出它与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
(2)实验室制取YW3的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)R2X2与W2X反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(4)写出铁在高温下与W2X反应生成磁性物质并产生W2气的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
(5)由W,R,X三种元素形成的离子化合物是强碱,写出它与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
17.在5L的密闭容器中进行下述反应:4NH3+5O2=═4NO+6H20,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是( )
| A. | V(O2 )=0.01mol•L-1•s-1 | B. | V(NO )=0.08mol•L-1•s-1 | ||
| C. | V(H2O)=0.01mol•L-1•s-1 | D. | V(NH3)=0.002mol•L-1•s-1 |
14.某烷烃的式量为72,跟Cl2反应生成的一卤代物只有一种,该烷烃是( )
| A. | 戊烷 | B. | 乙烷 | C. | 2-甲基丁烷 | D. | 2,2-二甲基丙烷 |
15.下列关于碱金属元素和卤素的说法中,错误的是( )
| A. | 钾与水的反应比钠与水的反应更剧烈 | |
| B. | 溴单质与水的反应比氯单质与水的反应更剧烈 | |
| C. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| D. | 碱金属元素中,锂原子失去最外层电子的能力最弱 |
16.设NA为阿伏伽德罗常数的数值,下列叙述不正确的是( )
| A. | 标准状况下,4.4g CO2中含有的原子数为0.3NA | |
| B. | 标准状况下,22.4L甲烷中含有的C-H键数为4NA | |
| C. | 5.6g 铁粉与硝酸反应失去的电子数可能为0.25NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 |

 .
.
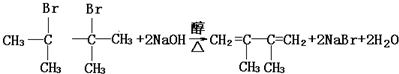 ;
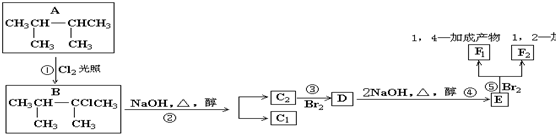
; 如图是一个化学过程的示意图.
如图是一个化学过程的示意图.