题目内容
15.下列各组离子能在溶液中大量共存的是( )| A. | Ag+,SO42-,NO3-,K+ | B. | Na+,HCO3-,Ba2+,NO3- | ||
| C. | Cl-,CO32-,Na+,Ca2+ | D. | Mg2+,SO42-,Na+,Cl- |
分析 A.银离子与硫酸根离子反应生成硫酸银沉淀;
B.四种离子之间不发生反应,能够共存;
C.钙离子与碳酸根离子反应生成难溶物碳酸钙;
D.四种离子之间不反应能够大量共存.
解答 解:A.Ag+、SO42-之间反应生成硫酸银,在溶液中不能大量共存,故A错误;
B.Na+、HCO3-、Ba2+、NO3-之间不发生反应,在溶液中能够大量共存,故B正确;
C.CO32-、Ca2+之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故C错误;
D.Mg2+、SO42-、Na+、Cl-之间不发生反应,在溶液中能够大量共存,故D正确;
故选BD.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
相关题目
5.以下现象中,不属于蛋白质变性的是( )
| A. | 鸡蛋白溶液中加入食盐变浑浊 | B. | 用氯化汞消毒医疗器械 | ||
| C. | 用波尔多液杀菌 | D. | 用福尔马林对种子消毒 |
6.下列关于实验现象的描述不正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 | |
| C. | 马口铁(镀锡铁)破损时与电解质溶液接触,铁先被腐蚀 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
8. 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )| A. | 22.40 mL | B. | 22.30 mL | C. | 23.65 mL | D. | 23.70 mL |

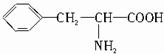 ,B的结构简式为
,B的结构简式为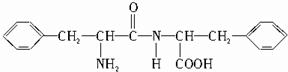 .
.