题目内容
1.硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取:SO2(g)+Cl2(g)?SO2Cl2(g)△H针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H1=-aKJ•mol-1
②SO2Cl2+SCl2(g)=2SOCl2(g)△H2=-bKJ•mol-1
③a>b>0则△H=-(a-b)kj•mol-1(用含a、b的代数式表示)
(2)为了提高该反应中Cl2的平衡转化率,下列措施合理的是AC(填字母序号).
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
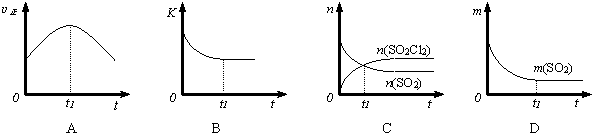
(3)若在绝热、恒容的密闭体系中,投入一定量SO2和Cl2,发生该反应,下列示意图能说明t1时刻反应达到平衡状态的是BD(填字母序号).(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)若在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P.起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L.
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示.则υ(SO2)=$\frac{0.4n}{t}$mol/min.
②此温度下,该反应的K=$\frac{80}{9n}$L/mol.
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是0.2nmol.
(5)该反应的产物SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式SO2Cl2+2H2O=H2SO4+2HCl
;已知25℃时,Ksp[AgCl]=1.8×10-10,Ksp[Ag2SO4]=1.4×10-5,则SO2Cl2于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是AgCl.
分析 (1)依据热化学方程式和盖斯定律计算得到;
(2)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,根据平衡移动原理结合选项分析解答,注意不能增大氯气的用量;
(3)A、到达平衡后正、逆速率相等,不再变化;
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、到达平衡后,各物质的物质的量不发生变化;
D、到达平衡后,各组分的含量不发生变化,质量不变;
(4)①依据化学平衡三段式列式计算,容积可变的密闭容器中,并始终保持温度为T,压强为P,气体体积之比等于气体物质的量之比;
②平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
③将nmolSO2与nmolCl2充入容积可变的密闭容器中,得到SO2Cl2,0.4nmol,则恒压容器中成正比例关系,则0.5nmol二氧化硫和0.5nmolCl2,反应生成SO2Cl20.2nmol;
(5)SO2Cl2遇水发生剧烈水解,且产生白雾,白雾是水解生成HCl与空气中水蒸气结合所致,则-SO2-基团结合2个-OH生成H2SO4;氯化银的溶解度远远小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀.
解答 解:(1)①SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H1=-aKJ•mol-1
②SO2Cl2+SCl2(g)=2SOCl2(g)△H2=-bKJ•mol-1
盖斯定律计算①-②得到:SO2(g)+Cl2(g)?SO2Cl2(g)△H=-(a-b)KJ/mol,
故答案为:-(a-b);
(2)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,不能增大氯气的用量,
A.缩小容器体积,压强增大,平衡向正反应移动,Cl2的转化率增大,故A正确;
B.使用催化剂,缩短到达平衡的时间,不影响平衡移动,Cl2的转化率不变,故B错误;
C.增加SO2浓度,平衡向正反应移动,Cl2的转化率增大,故C正确;
D.该反应正反应是放热反应,升高温度,平衡向逆反应移动,Cl2的转化率降低,故D错误;
故答案为:AC;
(3)A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后速率不变,故a错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确;
C、t1时刻后SO2(g),SO2Cl2(g)的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、t1时刻,SO2的质量为定值,处于平衡状态,图象与实际符合,故D正确;
故选BD;
(4)若在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P.起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L,设反应的二氧化硫物质的量为x,
SO2(g)+Cl2(g)?SO2Cl2(g)
起始量(mol) n n 0
变化量(mol) x x x
平衡量(mol)n-x n-x x
保持温度为T,压强为P,气体体积之比等于气体物质的量之比,2n:(2n-x)=10:8,
x=0.4n,
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示.则υ(SO2)=$\frac{0.4n}{t}$mol/min,
故答案为:$\frac{0.4n}{t}$mol/min;
②依据①结合平衡概念计算,K═$\frac{\frac{0.4n}{8}}{\frac{n-0.4n}{8}×\frac{n-0.4n}{8}}$=$\frac{80}{9n}$L/mol,
故答案为:$\frac{80}{9n}$L/mol;
③将nmolSO2与nmolCl2充入容积可变的密闭容器中,得到SO2Cl2,0.4nmol,则恒压容器中成正比例关系,相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,消耗二氧化硫物质的量为0.2n,混合物中SO2Cl2的物质的量是0.2nmol,
故答案为:0.2nmol;
(5)SO2Cl2遇水发生剧烈水解,且产生白雾,白雾是水解生成HCl与空气中水蒸气结合所致,则-SO2-基团结合2个-OH生成H2SO4,反应方程式为:SO2Cl2+2H2O=H2SO4+2HCl,氯化银的溶解度远远小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀,
故答案为:SO2Cl2+2H2O=H2SO4+2HCl;AgCl.
点评 本题考查热化学方程式和盖斯定律计算应用,化学平衡的影响因素、盐类水解分析、化学平衡计算等,掌握基础是关键,难度中等.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | CH3Cl  | B. | 乙烯的结构简式 CH2CH2 | ||
| C. | 淀粉的化学式为(C6H10O5)n | D. | H2O2的电子式: |
| A. | Ag+,SO42-,NO3-,K+ | B. | Na+,HCO3-,Ba2+,NO3- | ||
| C. | Cl-,CO32-,Na+,Ca2+ | D. | Mg2+,SO42-,Na+,Cl- |
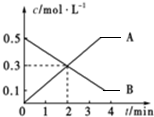
| A. | 前2 min内平均反应速率v(B)=0.3 mol•L-1•min-1 | |
| B. | 当A、B浓度不再变化时,此时反应速率为零 | |
| C. | 该反应的化学方程式为2A?3B | |
| D. | 前2 min内平均反应速率v(A)=0.15 mol•L-1•min-1 |
| A. | CH4 | B. | C2H4 | C. | C3H4 | D. | C3H8 |
| A. | AgCl沉淀多于AgBr沉淀 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | 只有AgBr沉淀生成 |
| A. | Fe3O4是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1mol NO,则转移电子数为2mol | |
| C. | 参加反应的氧化剂与还原剂的物质的最之比为28:3 | |
| D. | 若有3mol Fe3O4被氧化,则被还原的HNO3为1mol |
 ;
; 业生产中M与水反应的产物之一可用于漂泊和杀菌,写出M与水初步反应的化学方程式NCl3+3H2O═NH3+3HClO.
业生产中M与水反应的产物之一可用于漂泊和杀菌,写出M与水初步反应的化学方程式NCl3+3H2O═NH3+3HClO.