题目内容
【题目】1840年,Devil用干燥的氯气通过干燥的硝酸银制得了N2O5。
(1)F.DanielS等曾利用测压法在刚性反应器中研究了特定条件下N2O5(g)分解反应:
已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=-4.4kJmol-1
2NO2(g)=N2O4(g) ΔH2=-55.3kJmol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的ΔH=__kJmol-1。
O2(g)的ΔH=__kJmol-1。
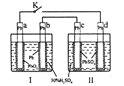
(2)查阅资料得知N2O5是硝酸的酸酐,常温呈无色柱状结晶体,微溶于冷水,可溶于热水生成硝酸,熔点32.5℃,受热易分解,很容易潮解,有毒。在通风橱中进行模拟实验制取N2O5的装置如图:
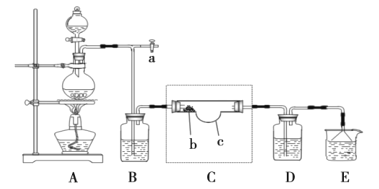
注:虚线框内为该组同学自制特殊仪器,硝酸银放置在b处。
请回答下列问题:
①实验开始前,需要打开a处活塞并鼓入空气,目的是__。
②经检验,氯气与硝酸银反应的产物之一为氧气,写出此反应的化学反应方程式__。
③实验时,装置C应保持在35℃,可用的方法是__。
④能证明实验成功制得N2O5的现象是__。
⑤装置D中的试剂是__,作用是__。
⑥装置E烧杯中的试剂为__。
【答案】53.1 除去装置C中的水蒸气 2Cl2+4AgNO3==4AgCl+2N2O5+O2 水浴等 装置C中c处有液体生成 浓硫酸 防止装置E中水蒸气从导管回流到装置C中,引起N2O5潮解 NaOH
【解析】
实验的目的,用干燥的氯气通过干燥的硝酸银制得了N2O5,所以A装置为Cl2的制取装置;由于N2O5很容易潮解,所以应将Cl2干燥后再通入C装置中,B、D装置中应放入浓硫酸;在C装置中,Cl2与浓硝酸反应生成AgCl、N2O5等,而N2O5的熔点为32.5℃,所以在35℃时,N2O5呈液态;E装置用于吸收尾气中的Cl2等。
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1= -4.4kJmol-1 ①
2NO2(g)=N2O4(g) ΔH2= -55.3kJmol-1 ②
利用盖斯定律,将(①-2×②)×![]() ,即得反应N2O5(g)=2NO2(g)+
,即得反应N2O5(g)=2NO2(g)+![]() O2(g)的ΔH=53.1kJmol-1。答案为:53.1;
O2(g)的ΔH=53.1kJmol-1。答案为:53.1;
(2)①N2O5很容易潮解,应将Cl2干燥后再通入C装置中,所以实验开始前,需要打开a处活塞并鼓入空气,目的是除去装置C中的水蒸气。答案为:除去装置C中的水蒸气;
②经检验,氯气与硝酸银反应的产物为AgCl、N2O5、O2,则此反应的化学反应方程式为2Cl2+4AgNO3==4AgCl+2N2O5+O2。答案为:2Cl2+4AgNO3==4AgCl+2N2O5+O2;
③实验时,装置C若用酒精灯火焰直接加热,很难将温度保持在35℃,可用的方法是水浴等。答案为:水浴等;
④N2O5的熔点为32.5℃,所以在35℃时,N2O5呈液态,所以能证明实验成功制得N2O5的现象是装置C中c处有液体生成。答案为:装置C中c处有液体生成;
⑤实验时,需防止E中产生的水蒸气进入C中,所以装置D中的试剂应能吸收水蒸气,应是浓硫酸,作用是防止装置E中水蒸气从导管回流到装置C中,引起N2O5潮解。答案为:浓硫酸;防止装置E中水蒸气从导管回流到装置C中,引起N2O5潮解;
⑥在装置C中,可能有一部分Cl2没有参加反应,所以装置E烧杯中应加入能吸收Cl2的试剂,其为NaOH。答案为:NaOH。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案