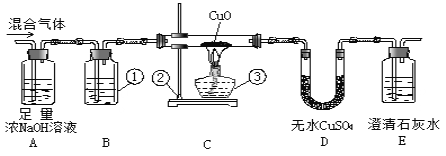
题目内容
【题目】微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。

请回答下列问题。
(1)该电池属于_________电池(填“一次”或“二次”)。
(2)负极是_________,电极反应式是__________________________。
(3)使用时,正极区的pH_________(填“增大”、“减小”或“不变”)。
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____。(填字母)
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2CO(g)+O2(g)=2CO2(1) △H<0
(5)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为__________。
【答案】一次 Zn Zn-2e-+2OH-=ZnO+H2O 增大 C CO-2e-+4OH-=C O 32-+2H2O
【解析】
(1)纽扣电池为一次电池;
(2)根据电池的总反应可知Zn为负极,失去电子,发生氧化反应,Ag2O为正极,得到电子,发生还原反应,据此分析作答;
(3)根据电池的总反应可知,Ag2O为正极,得到电子,发生还原反应,根据电极反应确定c(OH-)的变化以判断pH的变化;
(4)可设计成原电池的反应应为氧化还原反应;
(5)燃料电池中,负极通入燃料,燃料失电子发生氧化反应,正极通入氧化剂, 得电子发生还原反应,据此作答。
(1)纽扣电池为一次电池;
(2)根据电池的总反应可知Zn为负极,失去电子,发生氧化反应,电极反应为:Zn-2e-+2OH-=ZnO+H2O;
(3)根据电池的总反应可知,Ag2O为正极,得到电子,发生还原反应,电极反应为:Ag2O+H2O+2e-=2Ag+2OH-,使用时,c(OH-)增大,因此正极区的pH逐渐增大;
(4)A. 能设计成原电池的反应通常是放热反应,由于反应C(s)+H2O(g)=CO(g)+H2(g)是氧化还原反应,但该反应为吸热反应,因而不能设计成原电池,A项错误;
B. 反应NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)为复分解反应,不能设计成原电池,B项错误;
C. 反应2CO(g)+O2(g)=2CO2(1)为氧化还原反应,且该反应为放热反应,可设计成原电池,C项正确;
答案选C。
(5)燃料电池中,负极通入燃料,燃料失电子发生氧化反应,电极反应为CO-2e-+4OH-=CO32- +2H2O。

【题目】(1)下列原子或离子的电子排布的表示方法中,正确的是___,违反了能量最低原理的是___,违反洪特规则的是__。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:![]()
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦C:![]()
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(2)基态Al原子中,电子填充的最高能级是___,基态Cr原子的价电子排布式是___。
(3)用“>”或“<”填空:
第一电离能 | 沸点 | 离子半径 |
Be___B | H2S___H2O | Al3+___O2- |
(4)卟啉与Fe2+合即可形成血红素,Fe2+的电子排布式为___,铁在周期表中的位置为__。
【题目】根据下列实验操作和现象能得出相应结论的是( )
选项 | 实验操作 | 现象 | 结论 |
A | SO2缓慢通入滴有酚酞的NaOH溶液中 | 溶液红色褪去 | SO2具有漂白性 |
B | 将充满NO2的密闭玻璃球浸泡在热水中 | 气体红棕色加深 | 2NO2(g) |
C | 某黄色溶液X中加入淀粉-KI溶液 | 溶液变成蓝色 | 溶液X中含有Br2 |
D | 无水乙醇中加入浓硫酸,加热,产生的气体Y通入酸性KMnO4溶液 | 溶液紫色褪去 | 气体Y中含有乙烯 |
A. AB. BC. CD. D