题目内容
【题目】溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢被氧化。实验室制备![]() 的步骤如下:
的步骤如下:
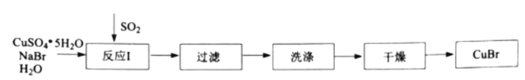
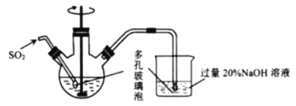
(1)反应Ⅰ在如图所示实验装置的三颈烧瓶中进行,实验所用蒸馏水需经煮沸,目的是除去水中的_________(写化学式)。
(2)反应Ⅰ中:三颈烧瓶中反应生成![]() 的离子方程式为________;烧杯中发生反应的化学方程式为________。
的离子方程式为________;烧杯中发生反应的化学方程式为________。
(3)过滤步骤中,需要在避光的条件下进行,原因是________。
(4)洗涤步骤中,依次用溶有少量![]() 的水、溶有少量
的水、溶有少量![]() 的乙醇、纯乙醚洗涤。洗涤剂需“溶有
的乙醇、纯乙醚洗涤。洗涤剂需“溶有![]() ”的原因是________。
”的原因是________。
(5)欲利用上述装置烧杯中的吸收液制取较纯净的无水![]() 晶体。
晶体。
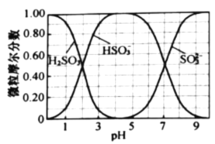
(水溶液中![]() 、
、![]() 、
、![]() 随
随![]() 的分布,
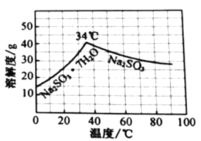
的分布,![]() 的溶解度曲线如题图所示)。
的溶解度曲线如题图所示)。
请补充完整实验方案[须用到![]() (贮存在钢瓶中)、
(贮存在钢瓶中)、![]() 计]:
计]:
①________;
②加入少量维生素C溶液(抗氧剂),加热浓缩溶液至有大量晶体析出;
③________;
④用无水乙醇洗涤2-3次;
⑤放真空干燥箱中干燥。
【答案】![]()
![]()
![]() 防止
防止![]() 见光分解 防止
见光分解 防止![]() 被氧化 向烧杯中继续通入
被氧化 向烧杯中继续通入![]() ,用
,用![]() 计测量溶液的
计测量溶液的![]() ,若
,若![]() 约为10,停止通
约为10,停止通![]() 在高于34℃条件下趁热过滤
在高于34℃条件下趁热过滤
【解析】
反应Ⅰ中,在三颈烧瓶中铜离子被![]() 还原为亚铜离子,与溴离子反应生成CuBr沉淀,再经过滤、洗涤、干燥得到
还原为亚铜离子,与溴离子反应生成CuBr沉淀,再经过滤、洗涤、干燥得到![]() ,烧杯中过量的NaOH溶液用于尾气处理,吸收多余的SO2气体,防止SO2逸出污染环境;同时需结合题干中有关物质性质的已知信息进行作答。
,烧杯中过量的NaOH溶液用于尾气处理,吸收多余的SO2气体,防止SO2逸出污染环境;同时需结合题干中有关物质性质的已知信息进行作答。
(1)由已知信息知,溴化亚铜能被氧气慢慢氧化,因此本实验反应Ⅰ中用二氧化硫还原铜离子生成溴化亚铜要排除空气中氧气的干扰,因此实验所用蒸馏水需经煮沸,目的是除去水中的![]() ;
;
(2)反应Ⅰ中,铜离子被二氧化硫还原成亚铜离子,与溴离子反应生成CuBr沉淀,根据得失电子守恒、电荷守恒、元素守恒配平该反应的离子方程式为: ![]() ;烧杯中NaOH溶液用于尾气处理,吸收多余的SO2气体,防止SO2逸出污染环境,NaOH溶液是过量的,则产物为Na2SO3,故发生反应的化学方程式为
;烧杯中NaOH溶液用于尾气处理,吸收多余的SO2气体,防止SO2逸出污染环境,NaOH溶液是过量的,则产物为Na2SO3,故发生反应的化学方程式为![]() ;
;
(3)由已知信息知,溴化亚铜见光会分解,所以过滤步骤中,需要在避光的条件下进行,是为了防止CuBr见光分解;
(4)由已知信息知,溴化亚铜在空气中会慢慢被氧化,所以洗涤步骤中,洗涤剂需“溶有![]() ”是为了防止
”是为了防止![]() 被氧化;
被氧化;
(5)上述装置烧杯中过量的NaOH溶液吸收![]() 生成
生成![]() ,且NaOH有剩余,因此为制取较纯净的无水
,且NaOH有剩余,因此为制取较纯净的无水![]() 晶体,结合水溶液中
晶体,结合水溶液中![]() 、
、![]() 、
、![]() 随
随![]() 的分布图可知:应先向烧杯中继续通入
的分布图可知:应先向烧杯中继续通入![]() ,与剩余的NaOH反应,并用
,与剩余的NaOH反应,并用![]() 计测量溶液的
计测量溶液的![]() ,若
,若![]() 约为10,停止通
约为10,停止通![]() ,从而得到
,从而得到![]() 溶液;根据
溶液;根据![]() 的溶解度曲线可知
的溶解度曲线可知![]() 在温度高于34℃的条件下溶解度逐渐减小,因此在加入少量维生素C溶液(抗氧剂),防止
在温度高于34℃的条件下溶解度逐渐减小,因此在加入少量维生素C溶液(抗氧剂),防止![]() 被氧化的同时,加热浓缩溶液至有大量晶体析出;再在高于34℃条件下趁热过滤,得到
被氧化的同时,加热浓缩溶液至有大量晶体析出;再在高于34℃条件下趁热过滤,得到![]() 晶体;再用无水乙醇洗涤2-3次,除去晶体表面的可溶性杂质;最后放真空干燥箱中干燥。
晶体;再用无水乙醇洗涤2-3次,除去晶体表面的可溶性杂质;最后放真空干燥箱中干燥。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】按如图装置进行实验,下列推断正确的是( )
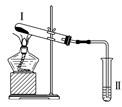
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D